国立研究開発法人 国立精神・神経医療研究センター(NCNP)
Tel:042-341-2711(広報係)
国立研究開発法人 日本医療研究開発機構
国立研究開発法人 国立精神・神経医療研究センター(NCNP、東京都小平市:水澤英洋理事長)神経研究所遺伝子疾患治療研究部(和田圭司 研究所所長/部長併任)の滝澤歩武研究員、青木吉嗣室長らは、難病のデュシェンヌ型筋ジストロフィー(DMD)患者さんの尿に含まれる細胞を使って、無侵襲で、かつ効率的にエクソン・スキップ治療の効果を検証するダイレクト・リプログラミング方法を確立しました。本成果により、患者さんが病院の外来を受診された際に少量の尿を頂くだけで、患者さん御自身の尿中細胞を筋細胞に変換する事ができるようになります。この結果、患者さん一人一人に対して、筋肉の病気の状態を調べる事ができるばかりか、様々なDMD遺伝子の変異ごとに治療薬の開発が可能となります。さらに、尿中細胞は、患者さんの年齢・性別にかかわらず、いつも通りトイレで排尿するだけで採取できます。本成果はあらゆる筋肉の病気に応用可能であり、筋肉の病気に対する研究が加速し、個別化(プレシジョン)医療の実現を加速する事が期待されます。本研究は、NCNP神経研究所と病院小児神経科の共同研究として、AMEDなどの支援によって行われたもので、研究成果は日本時間2019年3月7日午後7時(報道解禁日時:英国時間 3月7日午前10時)に『Scientific Reports』オンライン版に掲載されました。
研究の背景
デュシェンヌ型筋ジストロフィー(DMD)は、筋力が低下する遺伝性の難病であり、全世界で出生男児4,000-5,000人のうち1人の割合で発症します。現在、これまでステロイド剤以外の治療法がほとんどなかった同疾患を対象に、モルフォリノ核酸を用いた“エクソン・スキップ治療”の開発がすすんでいます。遺伝子疾患治療研究部では、国産初のアンチセンス核酸医薬品の開発を目指して、エクソン・スキップの誘導効果と安全性を、同疾患のマウスおよび犬モデルを用いて実証してきました。これらの成果を受けて、DMD患者さんを対象にしたエクソン53スキップの早期探索的臨床試験が、国立精神・神経医療研究センター病院で実施され、DMD患者さんにおいて本剤の安全性および治療効果を予測するジストロフィンタンパク質の発現を確認することに成功しました(Komaki. , et al. Science Translational Medicine; 2018)。日本新薬(株)は2016年1月より国内で第I/II相臨床試験を、また同年3月より米国で第II相臨床試験を開始しています。
DMDに対する新しい治療薬の開発(エクソン・スキップ薬等)や治療対象を選ぶ際には、患者さん由来の細胞を用いた薬効評価が必要です。滝澤歩武研究員、青木吉嗣室長らはこれまでに、患者さんに対して局所麻酔下に皮膚生検を行い、皮膚由来の線維芽細胞を採取して、筋制御因子であるMYOD1を導入して疾患筋細胞(筋管)に分化させ、薬剤の効果を細胞で評価する方法を確立しています(Saito T, et al. PLoS One. 2010;5:e12239.)。しかしながら、この方法は線維芽細胞を得るために侵襲的な皮膚生検を行う必要がありました。一方、最近では患者さん由来の細胞を無侵襲に採取する方法として、尿中に含まれる腎・尿路系上皮細胞(以下、尿中細胞と記載)が注目されています。しかし、MYOD1による筋細胞(筋管)への誘導効率が不十分で、エクソン・スキップ薬等の薬効評価に応用できるかについてはこれまで検証されていませんでした。
今回我々は、新しくTet発現誘導システムを活用したMYOD1レトロウイルスベクターを作成し、患者さん由来の尿中細胞を対象に、無侵襲で、かつ効率的なエクソン・スキップ薬等の細胞評価系を確立することを目的に研究を行いました。
研究の内容
研究グループは、まず複数の健常人から尿を採取し、遠心分離を行うことで尿中細胞を分離し、増殖培地中で培養しました。尿中細胞は全ての健常人から分離可能で細菌のコンタミネーションも少なく、細胞増殖能が高いため、安定して培養することができました(図1)。
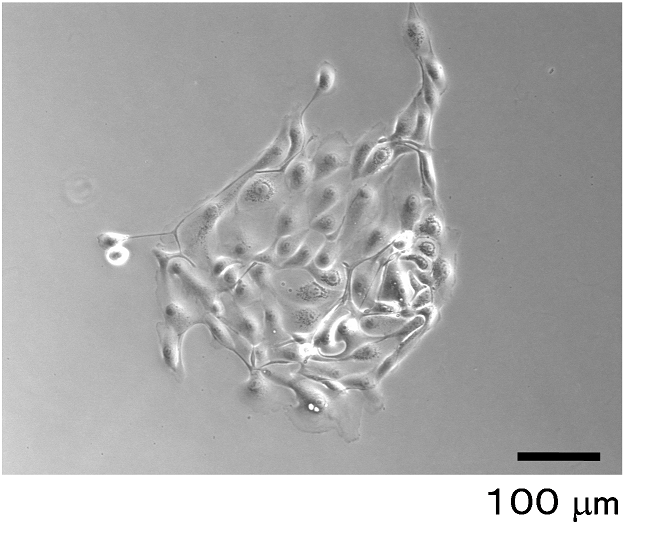
図1. 患者さんから採尿後、 増殖培地で7日間培養した初代尿中細胞の位相差顕微鏡像。この時期には増殖した尿中細胞を明瞭に認める。
次に、尿中細胞にMYOD1を導入し、分化培地中で疾患筋細胞(筋管)に分化させました。その際、ヒストンメチル基転移酵素阻害剤である3-deazaneplanocin A hydrochloride(DZNep)を分化培地に添加することで、筋管への分化に重要なMYOGENIN遺伝子の発現が有意に促進され、筋管形成までの時間が短縮するばかりか筋管分化度が著しく向上することを見出しました(図2)。
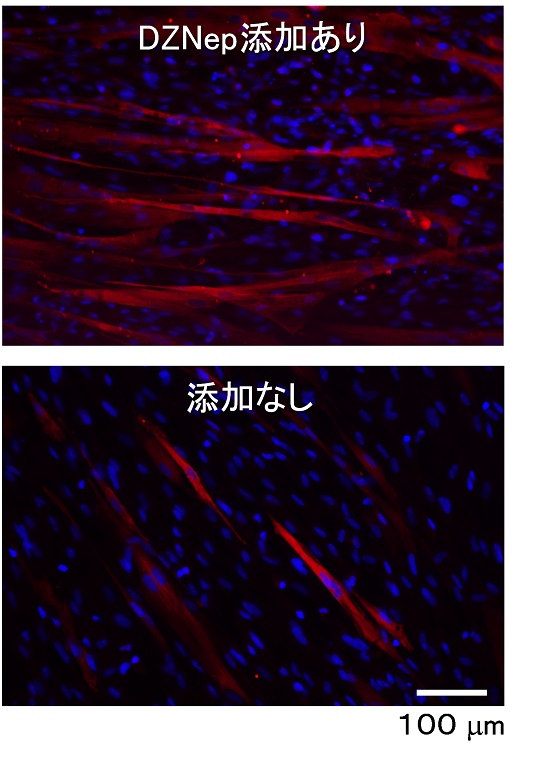
図2. MYOD1遺伝子により筋肉の細胞に変換した患者さん由来の初代尿中細胞のミオシン重鎖免疫細胞染色像 (分化誘導後14日目)。尿中細胞をMYOD1遺伝子により筋肉の細胞に変換した尿中細胞を増殖培地中で増殖させたのち、低栄養の分化培地中で筋管への分化誘導を行った。分化誘導開始から3日間は分化培地中に1μMの終濃度でヒストンメチル基転移酵素阻害剤(DZNep)を添加した。赤:ミオシン重鎖、青:核染色。
次に、エクソン・スキップ薬の効果を、実際にこの筋管で評価可能かを調べるため、様々なDMD遺伝子の欠失変異を有する複数の患者さんから採取した尿中細胞を培養し、上記の方法で筋管に分化させました。これらの筋管を対象にエクソン・スキップを行ったところ、薬物用量に依存してジストロフィンのメッセンジャーRNAがイン・フレーム化し、ジストロフィンタンパク質が回復することを確認できました(図3)。
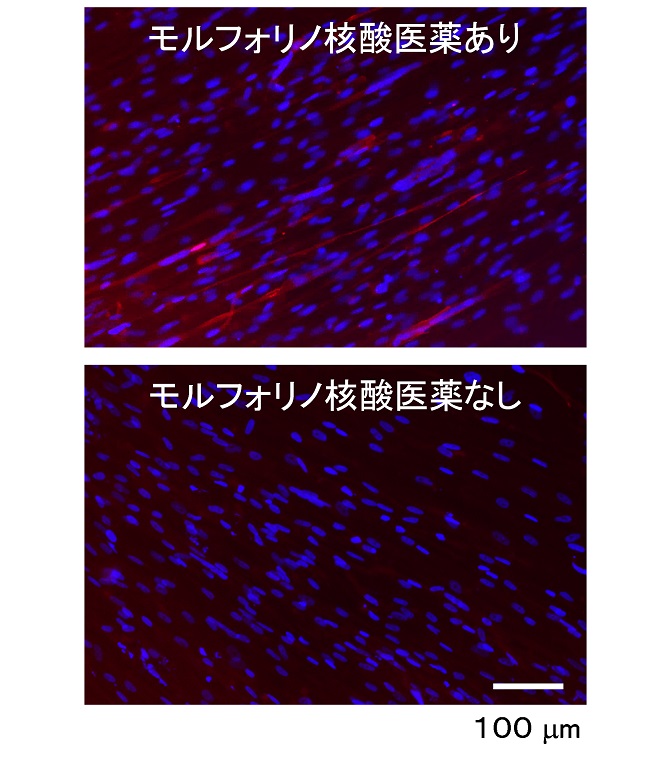
図3.エクソン・スキップ治療後のジストロフィン免疫細胞染色像。エクソン45の欠失変異を有するデュシェンヌ型筋ジストロフィー患者さんから尿中細胞を採取し、MYOD1遺伝子により筋肉の細胞に変換した。低栄養の分化培地中で筋管への分化誘導開始から3日間は分化培地中に1μMの終濃度でヒストンメチル基転移酵素阻害剤(DZNep)を添加した。分化誘導開始から7日目にモルフォリノ核酸医薬(5μM、終濃度)を2日間培地中に添加した。分化誘導開始から14日目に免疫細胞染色を行った。赤:ジストロフィン、青:核染色。
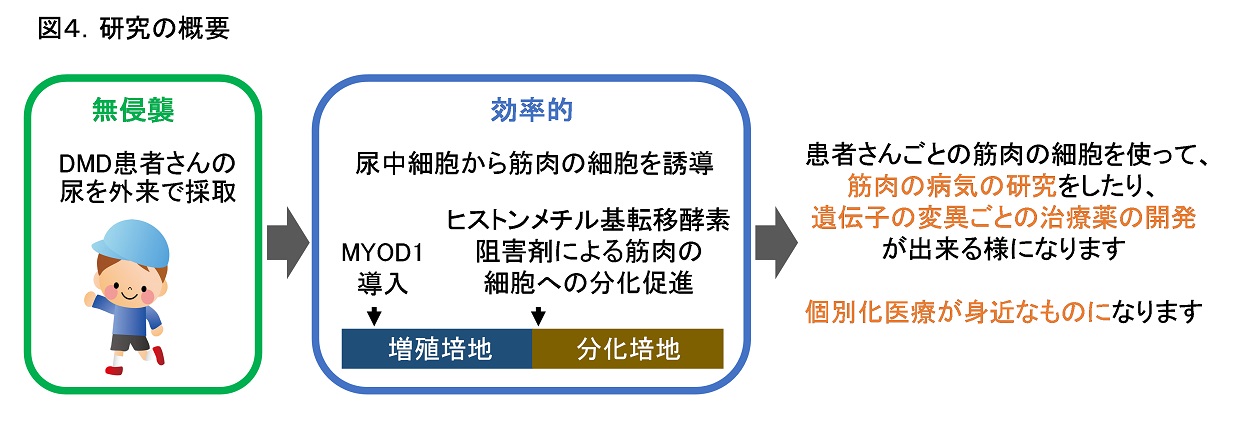
この方法を用いれば、特定のDMD遺伝子変異をもつ疾患筋細胞(筋管)を対象に、患者さんごとの病態を研究したり、エクソン・スキップを効率的に誘導可能な薬剤をスクリーニングするなどの治療法開発に応用することが可能です。さらに、DMD患者さんに負担をかけることなく、患者さん由来の疾患筋細胞を効率的に誘導できるため、プレシジョン医療による病態・治療研究が加速する事が期待されます(図4)。
今後の展開
本成果により、今後DMDを対象にした治療法開発が加速することが期待されます。また、尿中細胞は、患者さんの年齢・性別にかかわらず、簡便かつ低コストで採取できるため、DMD以外の筋疾患への応用も期待されます。本研究は、国立研究開発法人 日本医療研究開発機構(AMED)の難治性疾患実用化研究事業「新規配列連結型核酸医薬品を用いたデュシェンヌ型筋ジストロフィーに対するエクソン・スキップ治療の実用化に関する研究」(課題管理番号:17ek0109154h0003)及び橋渡し研究戦略的推進プログラム「デュシェンヌ型筋ジストロフィーに対する新規配列連結型核酸医薬品の医師主導治験」(課題管理番号:18lm0203066h0001)の支援により行われました。
筆頭著者の滝澤歩武研究員のコメント「研究に御協力頂いた患者さんと御家族に感謝しています。引き続き神経・筋疾患に対する新規治療法の開発、プレシジョン医療の推進につながるよう研究を進めていきたいと思います。」
責任著者の青木吉嗣室長のコメント「患者さんの尿を頂いて、その中に含まれる細胞(自然に尿中に脱落した細胞)をMYOD1遺伝子により筋肉の細胞に変換します。患者さんを傷つけることなく、患者さんごとの病態の研究と治療法の開発が出来る点で、患者さんの役に立つ研究成果です。」
原著論文情報
論文名: “Modelling Duchenne muscular dystrophy in MYOD1-converted urine-derived cells treated with 3-deazaneplanocin A hydrochloride”
著 者: 滝澤歩武、原 裕子、溝部吉高、大野泰輔、鈴木禎史、井上 健、竹下絵里、本橋-清水裕子、石山昭彦、星野幹雄、小牧宏文、武田伸一、青木吉嗣
掲載誌: Scientific Reports
URL: www.nature.com/articles/s41598-019-40421-z
用語の説明
デュシェンヌ型筋ジストロフィー (DMD)
DMDは、男児に発症する、もっとも頻度の高い遺伝性筋疾患で、ジストロフィンと呼ばれる筋肉の細胞の骨組みを作るタンパク質(ジストロフィンタンパク質)の遺伝子に変異が起こることで、正常なタンパク質が作れなくなり、筋力が低下してやがて死に至る重篤な疾患です。現在、その進行を遅らせる目的でステロイド剤による治療が行なわれていますが、それ以外に有力な治療法は存在せず、新たな治療法の開発が必要とされています。
エクソン・スキップ治療
「エクソン・スキップ治療」は、アンチセンス核酸と呼ばれる短い合成核酸(DNAの様なもの)を用いて、遺伝子の転写産物(メッセンジャーRNA)のうち、タンパク質に翻訳される領域(エクソン)の一部を人為的に取り除く(スキップする)ことで、アミノ酸読み取り枠のずれを修正(これをイン・フレーム化といいます)する治療法です。正常なジストロフィンタンパク質に比べると、その一部が短縮するものの、機能を保ったジストロフィンタンパク質が発現し、筋機能の改善が期待できます。
ダイレクト・リプログラミング法
分化した体細胞に、特定の制御因子(遺伝子やメッセンジャーRNAなど)を作用させることで、細胞の性質を変換し、別の種類の細胞に分化させることを指します。筋制御因子であるMYOD1は、ダイレクト・リプログラミングを誘導する代表的な因子です。遺伝子疾患治療研究部では、MYOD1を線維芽細胞に導入すると骨格筋細胞に変換できることを2010年に報告しています。
核酸医薬品
核酸医薬品は、遺伝子の構成成分であるDNA核酸と似た構造を持ち、疾患の原因になる遺伝子を標的とする薬剤です。その遺伝子から作られるタンパク質の産生を止める、又は調節することで効果を発揮します。従来の低分子医薬品では難しかった様々な疾患の治療が可能になると期待されており、特異性が高く安全性の面にも優れることから、次世代の医薬品として注目されています。
プレシジョン医療
個別化医療とも呼ばれ、患者さん一人ひとりに合わせた治療を実施する医療を指します。DMDに対するエクソン・スキップ治療は基本的に一つのエクソンを標的とするため、DMD遺伝子変異に対応した治療薬を選択する必要があります。さらに、同じDMD遺伝子変異を持っていても、患者さんごとに薬の効果や副作用の頻度が異なる可能性があります。プレシジョン医療は、患者さん一人ひとりに最適な治療法の選択を可能にします。一方、治療効果が見極められないまま治療する機会が減れば、費用対効果が改善すると期待されます。
筋管
単核細胞である筋芽細胞が融合して管状になった多核細胞を指します。さらに成熟した筋管細胞が集まると、収縮能を持つ筋線維となります。細胞実験では、筋芽細胞を増殖培地中で増殖させたのち、低栄養の分化培地に変更すると、数日から1週間程度で筋管が形成されます。筋分化が良好で、多くの筋芽細胞が融合すると、筋管は太く長くなります。
お問い合わせ先
【研究に関すること】
青木 吉嗣(あおき よしつぐ)
国立研究開発法人 国立精神・神経医療研究センター 神経研究所
遺伝子疾患治療研究部 室長
TEL:042-346-1720 FAX: 042-346-1750
E-mail:![]()
【報道に関すること】
国立研究開発法人
国立精神・神経医療研究センター
総務課 広報係
〒187-8551 東京都小平市小川東町4-1-1
Tel:042-341-2711 Fax: 042-344-6745
【事業に関するお問い合わせ先】
国立研究開発法人日本医療研究開発機構
戦略推進部 難病研究課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2223
E-mail:![]()



