オートファジーが神経の変性を促進するしくみを解明
■研究の背景・経緯
2016年のノーベル医学生理学賞を受賞された大隅良典先生(東京工業大学栄誉教授)がそのメカニズムを明らかにされたことで注目された「オートファジー」は、もともと細胞が栄養欠乏に陥った際に、細胞内の分子や小器官を分解してエネルギー供給の材料とするしくみとして発見され、その後、蛋白や細胞内小器官の分解を通して細胞の恒常性維持や機能調節など多様な役割を果たすことが明らかとなっています。
神経細胞におけるオートファジーの役割に関しても、活発な研究が行われてきました。これまでの研究報告によると、人工的にオートファジーが起こらなくした神経細胞では、神経難病(パーキンソン病、アルツハイマー病、筋萎縮性側索硬化症など)で見られるのと類似した神経細胞内の異常な蛋白凝集が観察されることが明らかにされたことから、神経細胞においては普段からオートファジーによるタンパク分解がいつも行われていることにより、異常な蛋白の蓄積が防がれ、神経細胞の健全性が維持されているものと考えられています。
神経細胞は、軸索や樹状突起と呼ばれる長い突起をもち、他の細胞と連絡することで機能しています。傷害や病気によって神経の軸索が徐々に失われる(このことを神経軸索の「変性」と言います)際には、軸索中でオートファジーが活発に起こることが観察されており、オートファジーが神経変性の進行に関与する可能性が考えられています。しかし、多くの細胞種においてオートファジーを引き起こす刺激となることが知られている「飢餓(栄養の欠乏)状態」によっては神経細胞でのオートファジーは誘導されにくいこともわかっており、神経細胞におけるオートファジーの研究は困難で、変性する軸索中で見られるオートファジーが軸索を壊そうとする反応なのか、壊れるのを止めようとする反応なのかもはっきりしていませんでした。
我々の研究グループは、2011年、2015年に発表した一連の研究において、軸索の損傷が起こると軸索内の骨組みを形成している「微小管(*1)」と呼ばれるたんぱく(細胞骨格)の安定性を制御するメカニズムが変化することによって神経突起構造崩壊が誘導されることを明らかにしました。(図1)このメカニズムにおいて、神経傷害後、GSK3Bと呼ばれるリン酸化酵素が活性化して、細胞骨格を不安定化して神経変性を誘導するシグナル伝達が起こることがわかっています。
■研究の内容
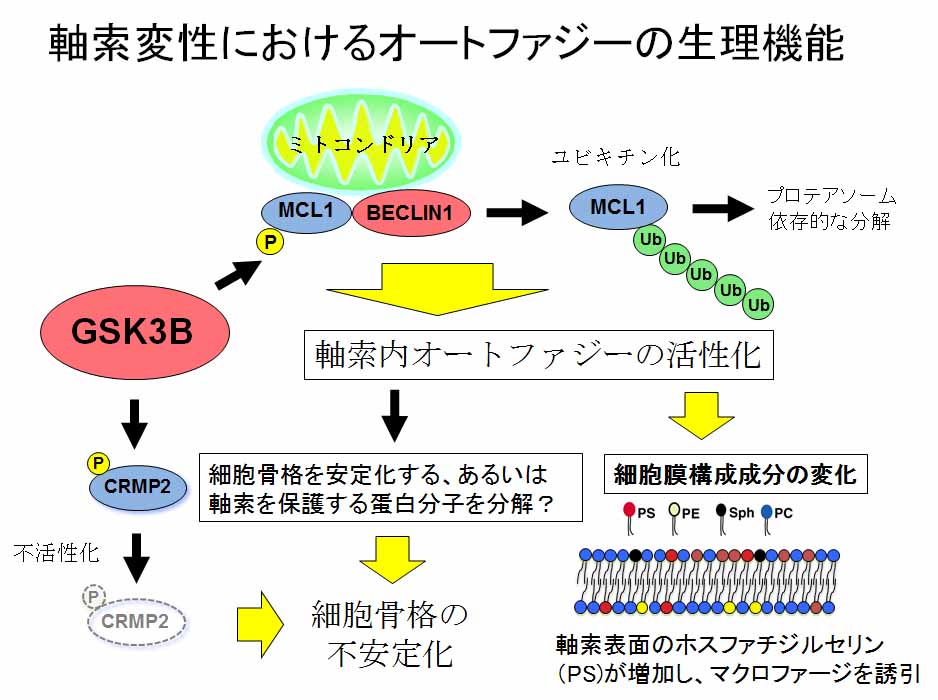
今回,我々は、以前の研究で見出したリン酸化酵素GSK3Bが、MCL1と呼ばれるタンパクをリン酸化(*2)することにより、これまでに明らかにしたのとは別の細胞内シグナル伝達を惹起することを明らかにしました。MCL1は普段はミトコンドリアの膜上に存在しています。ミトコンドリア上では、MCL1は、BECLIN1というオートファジーを制御するタンパクの一つと結合していると考えられます。今回の研究の結果、神経損傷などの神経を傷害する刺激によって、神経軸索内でGSK3Bが活性化すると、MCL1はGSK3Bによってリン酸化されることがきっかけとなってBECLIN1から離れて分解されてしまうこと、MCL1から離れたBECLIN1が、軸索の中でオートファジーを活性化することが明らかとなりました。
このようにして、神経軸索中で活性化されたオートファジーは、神経傷害後の変化にどのような役割を果たしているのかについて、研究グループでは更に検討を行いました。その結果、オートファジーを起こすのに必要な分子の量が細胞内で減少した状態の神経細胞に傷害を起こすと、神経軸索変性の進行が遅くなることがわかりました。さらに、神経細胞内でMCL1の量を減らすことによって、BECLIN1によるオートファジー活性化を人工的に誘導すると、そのことによって軸索が変性することもわかりました。これらのことから、神経軸索中で活性化されたオートファジーは、軸索の変性を進める作用があることがわかりました。
我々の以前の研究で示した「細胞骨格の不安定化」など、神経傷害後に神経軸索を変性させる細胞内シグナルは、今回明らかにしたオートファジー活性化のほかにも存在することがわかっています。それでは、このようないくつかの細胞内シグナル経路の中で、オートファジーの活性化は、他のシグナル経路とは違う特別な役割を持つのでしょうか。今回の研究において、研究グループは、オートファジーがエネルギーを産生するための仕組みであることに注目し、オートファジーによって軸索内で産生されるエネルギーが何に必要なのかを検討しました。その結果、神経傷害後にオートファジーを抑制すると、変性によって壊れてしまった細胞の残骸などを食べてしまう血液中の細胞(マクロファージ*3と呼ばれる細胞)が傷害部位に集まりにくくなってしまうことがわかりました。これらの結果から、神経傷害後に神経軸索中でおこるオートファジーは、神経軸索の変性を加速し、神経損傷部位にマクロファージを呼び寄せて細胞の残骸を処理する働きを高めていることがわかりました。
■今後の展望
今回の研究で、MCL1の分解によりBECLIN1が引き起こす神経軸索中のオートファジーによって、神経軸索の変性が起こることがわかりました。このようにして神経細胞の中でオートファジーが誘導できることはこれまで全く知られていませんでした。今回の研究では、神経傷害をモデルとしてオートファジーの役割についての検討を行いましたが、研究グループでは、このようなオートファジーが、さまざまな神経の病気においてどのような役割を果たしているのかを今後検討することによって、神経難病などの治療に役立てることを目指しています。さらに、神経の発達過程や学習・記憶など神経細胞の生理的な変化においても役割を果たす可能性についても今後検討していきたいと考えています。<ことば>
1.微小管:細胞の構造を支える骨組み(細胞骨格)の一種。チュブリンと呼ばれるタンパク質が多数重合したり、バラバラになったりすることで、細胞の形態維持や変化,細胞分裂,繊毛の運動など、細胞のさまざまな機能に重要な役割を果たす。 2.リン酸化:タンパク質分子などにリン酸基を付加する反応。リン酸化によってタンパク質分子のはたらきが変化したり、細胞内での局在や他のタンパク質分子との会合状態が変化したりすることから、細胞の生存や機能維持に極めて重要である。 3.マクロファージ:白血球の一種。貪食細胞などとも呼ばれる。死んだ細胞や体内に侵入した細菌などを捕食して除去する機能、免疫における機能などをもっている。図1: 以前の研究で示した細胞骨格の安定性制御機構
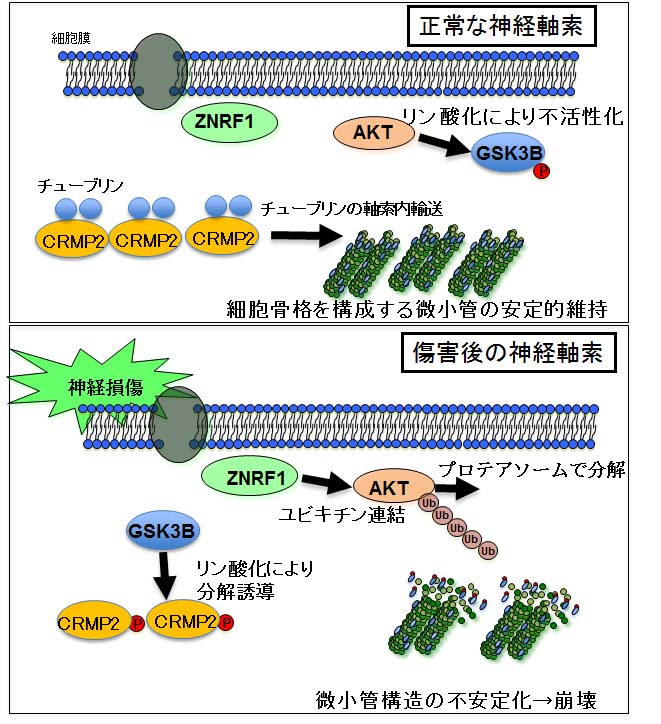
図2:本研究の成果内容の概略図