研究概要
疾病研究第五部は、神経変性のメカニズムの解明と疾患治療への応用に関する研究を行っています。
高齢化社会の進展に伴って、老化とともに進行する疾患への治療アプローチは一層その重要度を増しています。
アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症などの神経変性疾患は、多くの場合老化と共に発症・進行する難病であり、これらの疾患に対する有効な治療法の開発は今後の高齢化社会における重要な課題です。また、脱髄・変性を伴う末梢神経の疾患は、致命的ではないものの、やはり有効な治療法がないのが現状です。
神経変性・保護・再生に関わる細胞内プロセスは、神経細胞の発生・分化メカニズムと多くの共通点があり、また個体のエネルギー代謝など生物個体全体の生理・病理的変化にも大きく影響されます。私たちは、神経系を構成する神経細胞、グリア細胞の分化、エネルギー代謝、機能維持などのメカニズムを理解することによって、神経変性過程の抑制・神経保護的疾患治療の実現を目指しています。また、同様の方法を神経細胞の老化抑制に応用することによって、高齢者における神経系の正常機能のより長期間の維持を目指します。
主な研究リスト
- 神経突起変性に着目した神経変性メカニズムの解明とその治療応用
- 家族性筋萎縮性側索硬化症(FALS)における運動神経変性の初期過程について
- 末梢神経軸索髄鞘化の制御について
- 幹細胞技術を用いた神経変性疾患の病因研究
神経突起変性に着目した神経変性メカニズムの解明とその治療応用
神経突起変性に着目した神経変性メカニズムの解明とその治療応用
神経突起 の変性は、多くの神経疾患・神経傷害の一部として、発症・細胞傷害機序に重要な役割を果たしています。神経突起の変性は単に細胞体から分離した軸索が消えていく受動的過程でなく、アポトーシスに匹敵するような一連の転写制御と酵素活性化を必要とする過程であると考えられます。軸索変性は神経変性性疾患の症状の多くの発生に寄与しており、実際、疾患モデルマウスにおいて軸索変性を抑制することにより症状の改善と疾患による死の時期を遅らせる効果が見られる例が報告されています。
■1
我々はNMNAT蛋白のNADを作り出す酵素活性の亢進がSir2alpha/SIRT1 histone/protein deacetylaseの活性を介して軸索変性遅延を引き起こすことを明らかにしましたが、その後の研究により、NMNAの過剰発現はこのメカニズムのほか、神経細胞のミトコンドリアにおけるエネルギー代謝の改変を介した細胞内反応経路により、より強力な保護効果をもたらすことが明らかとなりました。(2009年の八幡らの論文参照)
NAD投与、NMNAT活性の発現による神経保護効果は神経突起の保護のみならず、一部のストレスや疾患モデルに対しては神経細胞全体に対する保護効果をしめすことからもわかるように、保護の有無・効果の大小は、疾患モデルにおける神経細胞傷害メカニズムと密接なつながりがあります。今後更にNAD・NMNATによる神経保護のメカニズムと疾患モデルにおける効果の詳細を検討していきます。
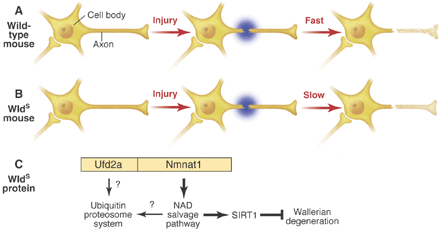
我々の論文に関する解説記事(Science, 305:954-955,2004)より。
■2
軸索変性過程にはユビキチン・プロテオソーム(UPS)系が関与することが知られています。我々が発見した新しいE3 Ubiquitin ligase familyであるZNRF1,2のうち、ZNRF1は、神経軸索変性開始に伴って、リン酸化酵素であるAktのUPS系での分解を誘導することによって、軸索内の骨組みを形成している微小管(細胞骨格)を不安定化し、神経突起構造崩壊を誘導することを2011年に報告しました。さらに、2015年には、活性酸素が細胞内で情報伝達因子として作用することによってZNRF1を活性化すること、そしてZNRF1の活性化は細胞死と軸索崩壊の両方を引き起こすことを、マウスで作成した脳卒中、パーキンソン病、神経損傷のモデルにおいて示しました。今後、ZNRF1蛋白の活性化機序の詳細、Akt-GSK3Bカスケードの下流現象の詳細をさらに明らかにすることを目指します。
また、UPS系の抑制とNAD/Sir2系活性化はいずれも軸索保護作用があり、このことは両方の細胞内反応系がどこかでつながっていることを示唆しています。今後、軸索変性過程におけるこの両者 のつながりを明らかにすることにより、軸索変性に関わる細胞内反応の全体を解明し、その有効な防止法の臨床応用をめざします。
■3
神経突起変性過程に関与する遺伝子のスクリーニングを行い、神経突起変性過程の詳細の解明、神経細胞死との関係の解明を目指します。
家族性筋萎縮性側索硬化症(FALS)における運動神経変性について
ALSの発症メカニズムは、未だに解明されていません。ALSに関する研究としては、家族性ALS(FALS)の中で最も高頻度な変異であるSuperoxide dismutase(SOD)1遺伝子変異によって生じる変異型SOD1がどのような機序で運動神経傷害を引き起こすかに関する研究が最もよく行なわれています。(下図1)我々は、ミスフォールド化した変異型SOD1蛋白が、軸索輸送関連蛋白に結合し、その蛋白が本来担う軸索輸送を傷害するために運動神経障害が引き起こされる可能性に着目し、そのメカニズムの詳細に関する研究を行なってきました。(下図2)
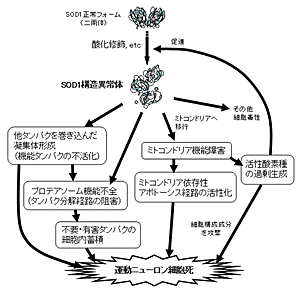
図1 ALSの細胞傷害メカニズムに関する仮説 [図を拡大する]
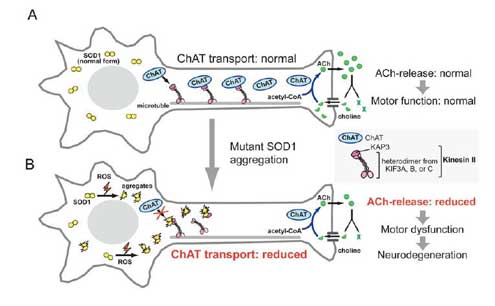
図2 軸索順行性輸送障害による運動神経機能障害モデル [図を拡大する]
また、最近の研究において、我々は、SOD1のミスフォールド化の機序に関する研究について報告しました。我々は以前、培養細胞などを用いた研究により、SOD1蛋白質のアミノ酸配列の中で111番目にあるシステインと呼ばれるアミノ酸(Cys111)が変異型SOD1では酸化による変化を受けやすく、それにより変異型SOD1蛋白質のミスフォールド化が起こって神経細胞に対して毒性となる可能性を指摘していました(Watanabe
S et al. Free Radic Biol Med 42, 1534-1542, 2007, Kishigami et al. Free
Radic Biol Med 48, 945-952, 2010)。最近の研究では、我々は、この変異型SOD1のCys111が生体内でALS病変を生じる際に重要であるかにつきマウスを用いた検討を行い、ALSで同定されている変異(H46R、46番目のアミノ酸であるヒスチジンがアルギニンに変化したもの)を持つヒトSOD1を発現するマウス(H46R
SOD1マウス)のALS様症状の発症は、さらに111番目のシステインを別のアミノ酸に置換することによって遅延することを示しました。この研究は、変異型SOD1によるALSの発症にCys111が重要な役割を果たすことを動物実験により初めて明確に示したものであり、このCys111の酸化を抑えることにより変異型SOD1に関連したALSの新たな治療法を開発できることが期待されます。
今後さらに、ALSのなかで大多数を占める弧発性ALSにおいてこのメカニズムの持つ意義、また、異常蛋白質が凝集化して細胞傷害性を獲得する分子機序に関する研究を行うことで、ALS発症機序の一端を解明し、治療法開発に結びつけることを目指しています。
末梢神経軸索髄鞘化の制御について
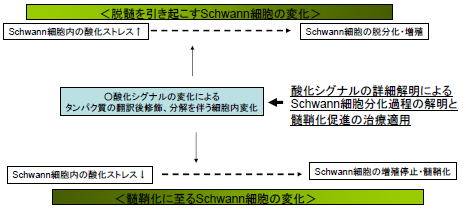
Schwann細胞は末梢神経においてミエリン(髄鞘)を形成しているグリア細胞であり、末梢神経に特有な神経再生能力に必要不可欠な役割を果たしています。末梢神経発生、傷害モデルにおける変性・再生過程におけるSchwann細胞の遺伝子発現制御メカニズムに関してはこれまでさまざまな研究が行われており、多くの知見が得られています。我々は、これらに加えて、Post-translationalな蛋白発現制御がミエリン化に影響を及ぼしていることを示しました(2010年の齋藤らの論文)。グルタミン合成酵素(Glutamine synthetase; GS)は、神経傷害後のSchwann細胞において、主としてプロテアソームにおける分解によってその発現量が大きく減少します。我々は、神経傷害後Schwann細胞では酸化ストレスが高まること、GSを含め多くの蛋白が酸化修飾をうけて分解が誘導される可能性があること、GS蛋白の発現量はSchwann細胞のミエリン化を誘導することができることから、この一連のプロセスはSchwann細胞の分化状態を制御している可能性があることを明らかにしました。
また、最近の研究において、我々は、グルタミン酸はSchwann細胞に発現する代謝型グルタミン酸受容体mGluR2を介してSchwann細胞への情報伝達を行うこと、mGluR2の下流シグナルにはGbeta-gamma、Srcが関与し、Neuregulin1-ErbB2/3シグナルによるMAPキナーゼリン酸化を強めることによって、Schwann細胞の脱分化・増殖促進をもたらすことを示しました。mGluR2シグナルの阻害は末梢神経の脱髄抑制・髄鞘化促進作用を示すことから、末梢神経脱髄疾患に対する治療への応用が期待されます。
今後さらに、発生過程における末梢神経髄鞘化調節機序の解明と髄鞘化に影響を与える因子の探索を通して、末梢神経脱髄疾患治療法の開発を行うことを目指します。
疾患特異的iPS細胞を用いた筋疾患・神経変性疾患の病因病態研究と治療法開発
iPS細胞の作成技術が開発され、疾患研究への応用が社会的にも期待されています。我々は、AMED再生医療実現拠点ネットワークプログラム 疾患特異的iPS細胞を活用した難病研究の「疾患特異的iPS細胞を活用した筋骨格系難病研究」、技術開発個別課題「難治性筋疾患に対する細胞移植治療法の開発」に参画しています。また、センター病院などとの連携のもと、神経変性疾患の病因究明にiPS細胞技術を応用することによって取り組んでいます。