- AuthorIkuo Tomioka, Hidetoshi Ishibashi, Eiko N. Minakawa, Hideyuki H. Motohashi, Osamu Takayama, Yuko Saito, H. Akiko Popiel, Sandra Puentes, Kensuke Owari, Terumi Nakatani, Naotake Nogami, Kazuhiro Yamamoto, Satoru Noguchi, Takahiro Yonekawa, Yoko Tanaka, Naoko Fujita, Hikaru Suzuki, Hisae Kikuchi, Shu Aizawa, Seiichi Nagano, Daisuke Yamada, Ichizo Nishino, Noritaka Ichinohe, Keiji Wada, Shinichi Kohsaka, Yoshitaka Nagai, Kazuhiko Seki
- Scholarly journalJournal of Physiology, doi:10.1113/JP278292
研究の背景
神経変性疾患とは、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)、ポリグルタミン病(家族性脊髄小脳変性症を含む)などの疾患の総称で、脳や脊髄にある神経細胞のうち、ある特定の領域の神経細胞が徐々に脱落する病気です。日本国内だけでも400万人以上の患者さんがいると推定されており、高齢化社会の進行に伴って患者さんの数が増えています。もの忘れ・手足のふるえや動かしづらさ・歩行時のふらつきなど、個々の疾患に特有の症状が出現し、徐々に進行しますが、その原因にはいまだ不明な点が多く、疾患の進行を止める根本的な治療法は確立されていません。
ヒトの疾患に対する新たな治療法や診断法を開発するためには、ヒトの病態を再現した疾患モデル動物を用いて得られた基礎研究の成果をヒトにおける臨床研究へと展開する、いわゆるトランスレーショナル・リサーチ(橋渡し研究)が必須です。神経変性疾患においても、これまでに、齧歯類(ラットやマウスなど)のモデル動物を用いた基礎研究の成果をもとに、数多くの臨床研究が試みられています。しかしながら、基礎研究で効果が確認された治療薬の候補がヒトにおいては効果が乏しいなど、基礎研究から臨床研究への橋渡し研究の多くが成功に至っていないのが現状です。
その大きな原因として、齧歯類の脳の構造や機能にはヒトとは異なる点が多いこと、また、薬剤などの効果や副作用も齧歯類とヒトとでは大きく異なることが挙げられます。より効果的に橋渡し研究を推進するため、すなわち、基礎研究で得られた成果を確実に臨床研究へつなげ、新しい治療法を開発するためには、脳の構造や機能、薬剤などの代謝経路がヒトに近似している霊長類を用いて、神経変性疾患のモデル動物を確立することが必要です。
そこで、NCNPは小型霊長類であるコモンマーモセット(Callithrix jacchus、図1)に注目しました。実験動物として用いられる霊長類には、他にもマカクサル等がありますが、コモンマーモセットは霊長類の中では珍しく多産で、性成熟までの期間や妊娠期間、出産間隔が短いため、マカク類と比較して繁殖効率がよいこと、また、比較的小型(3-400 g)であることから、橋渡し研究に必要な個体数を確保しやすいのが特徴です。さらに、高次脳機能を司る前頭葉の割合がヒト同様に大きく、高い社会性を持っています。また齧歯類よりも脳が大きいことから、ヒトで用いられる頭部MRIなどの画像診断法を用いて脳を解析することが可能です。このようにコモンマーモセットは、多くの観点で齧歯類やマカクサルよりもヒトのモデルに適した特徴を持っており、様々な研究に応用される可能性を秘めています。わが国では、コモンマーモセットを用いた遺伝子改変動物作製技術が世界に先がけて確立されました。NCNPではこの技術を応用し、ポリグルタミン病の遺伝子改変モデルマーモセット系統の確立に世界で初めて成功しました。
研究の内容1:遺伝子改変コモンマーモセットの作出に成功
ポリグルタミン病は、いくつかの家族性脊髄小脳変性症(SCA1、SCA 2、SCA 3、SCA 6、SCA 7、SCA 17、歯状核赤核淡蒼球ルイ体萎縮症)、ハンチントン病、球脊髄性筋萎縮症の総称です。ポリグルタミン病の各疾患の原因遺伝子内では、CAG配列の繰り返し(CAGリピート)回数が健常人よりも増えています。このCAG配列はグルタミンというアミノ酸を作るため、原因遺伝子産物である蛋白質の中に健常人よりも長いグルタミン鎖が挿入された、ポリグルタミン蛋白質が生成されます。このポリグルタミン蛋白質は神経細胞に蓄積すると細胞の機能を低下させ、神経細胞を脱落させることが知られています。
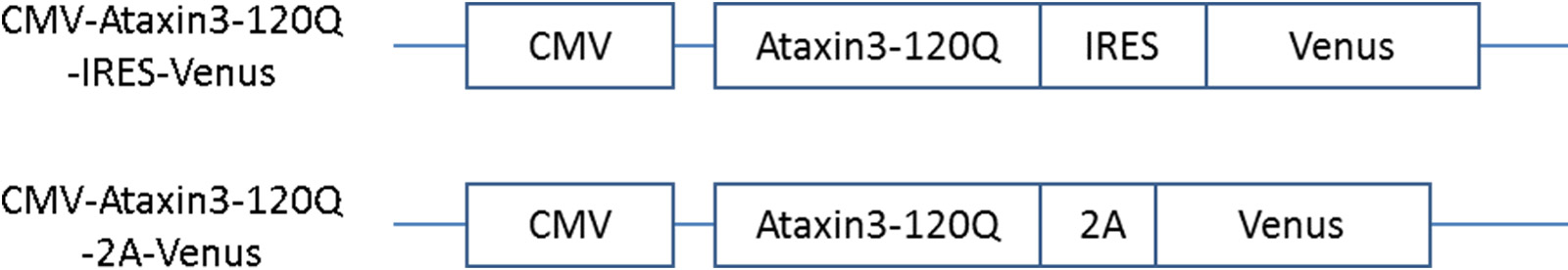
ポリグルタミン病のうち家族性脊髄小脳変性症は、小脳や脊髄などの神経細胞が変性・脱落して、歩行時のふらつき(運動失調)などの様々な神経症状が徐々に進行する疾患です。本研究では、ポリグルタミン病のうち世界的にも頻度が高く、わが国の家族性脊髄小脳変性症のうち約30%を占めるマシャド・ジョセフ病(SCA3)をターゲットとしました。SCA3は、原因遺伝子であるAtaxin 3 内にあるCAGリピートの異常伸長により引き起こされることが知られています。そこで、Ataxin 3内のCAG リピートを異常伸長させた疾患原因遺伝子(図2、Ataxin 3-120Q)を合成し、遺伝子を細胞内へ運ぶウイルスベクターを介して、マーモセット受精卵へ遺伝子導入を行いました。
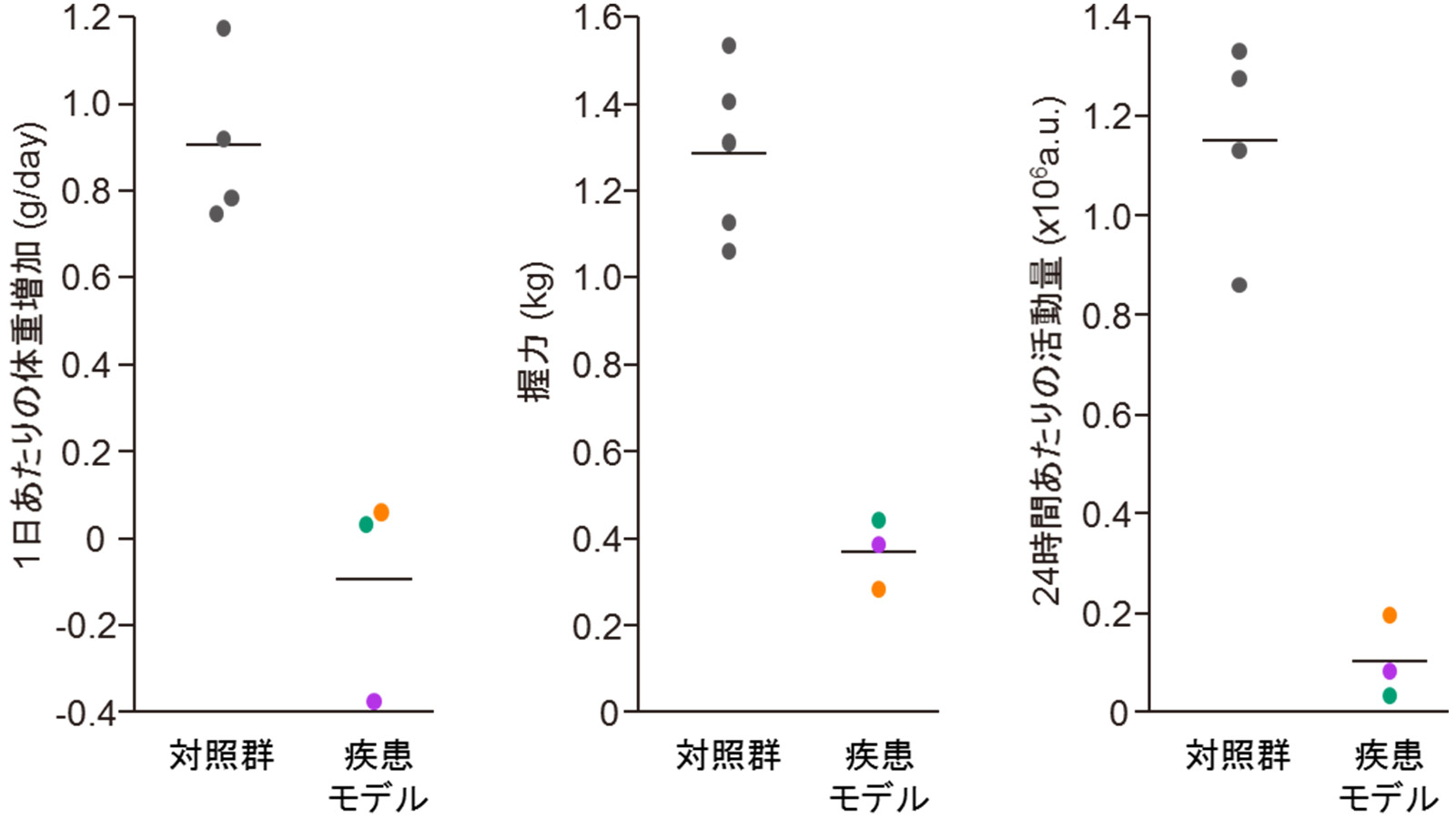
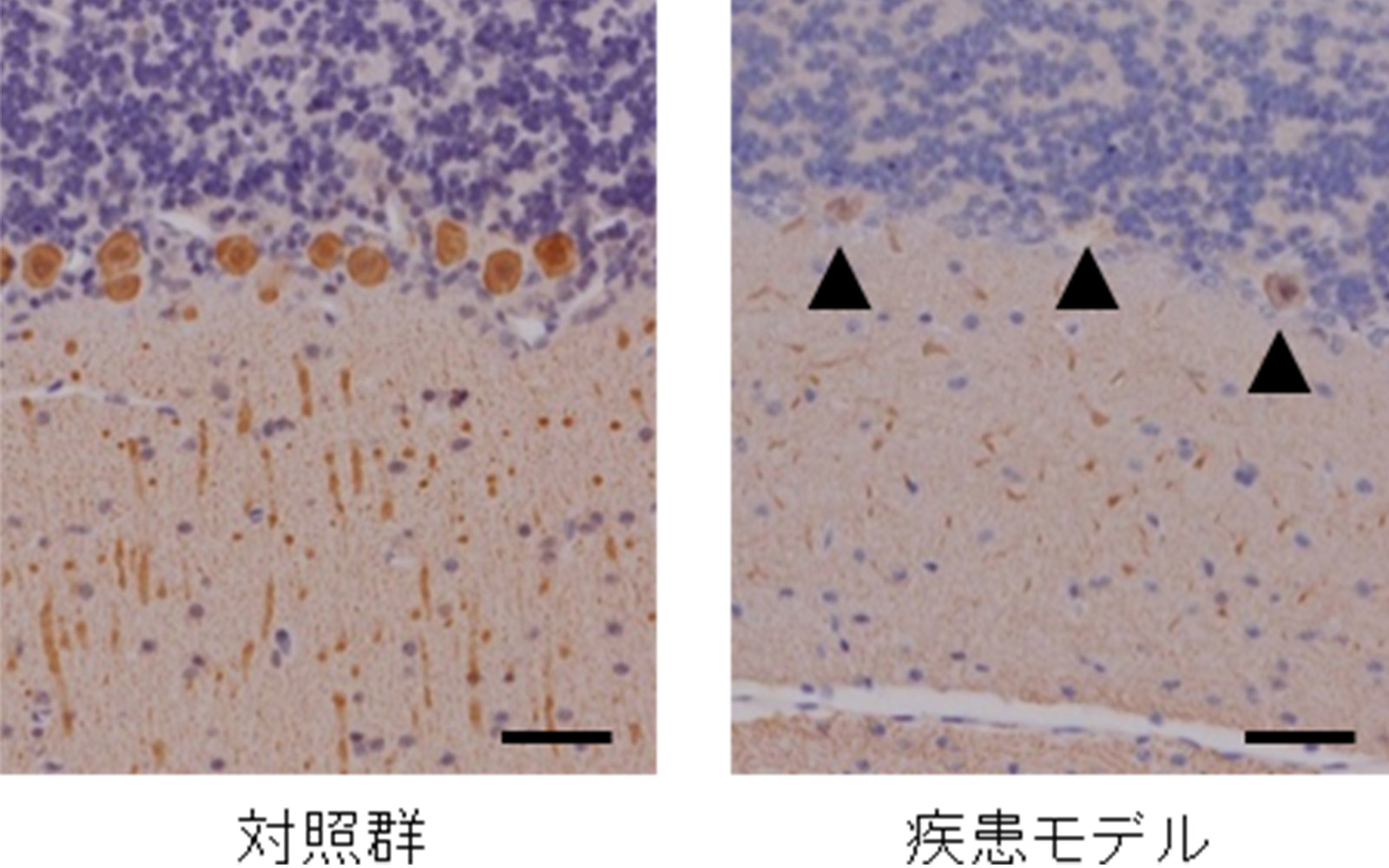
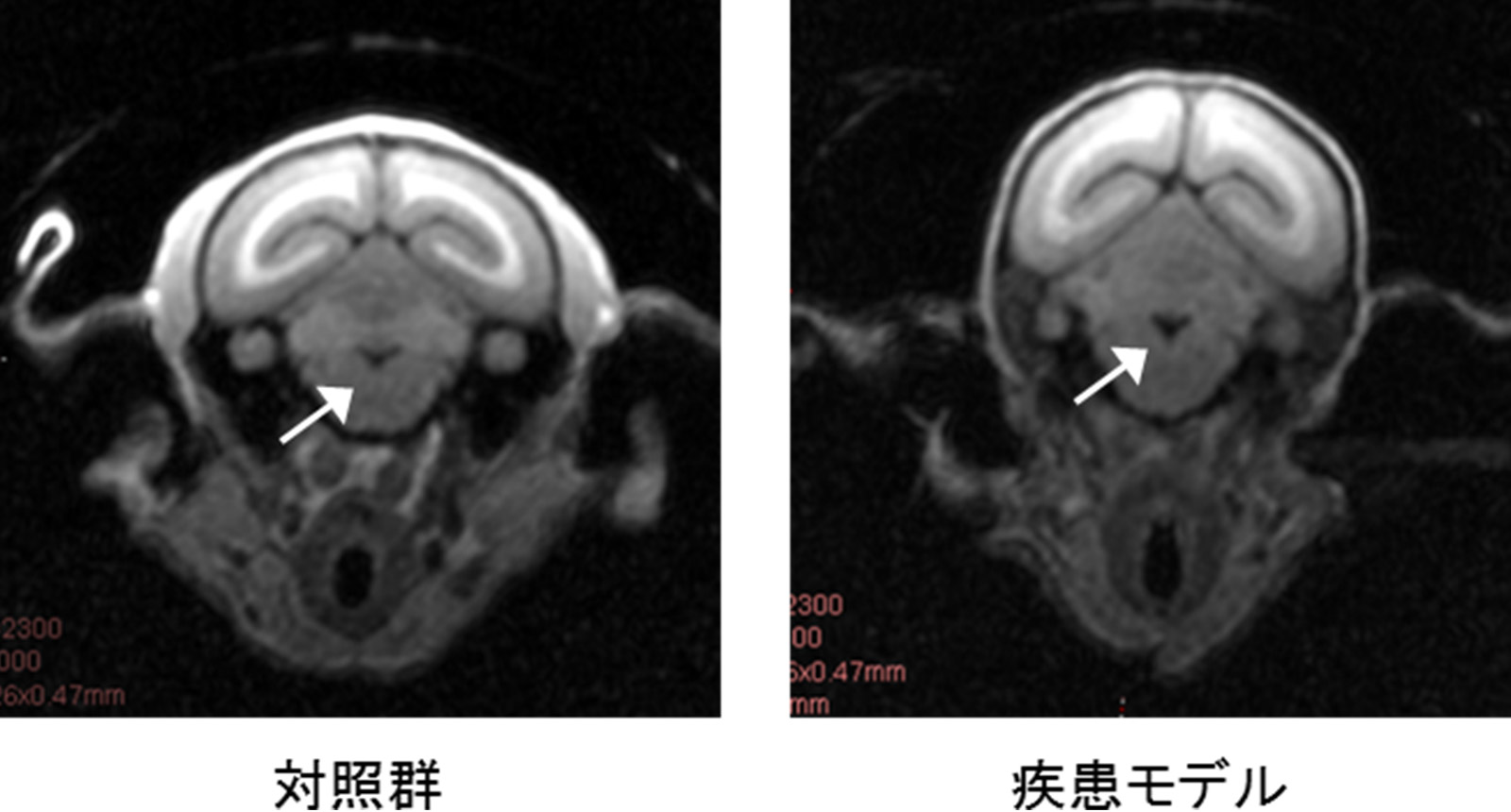
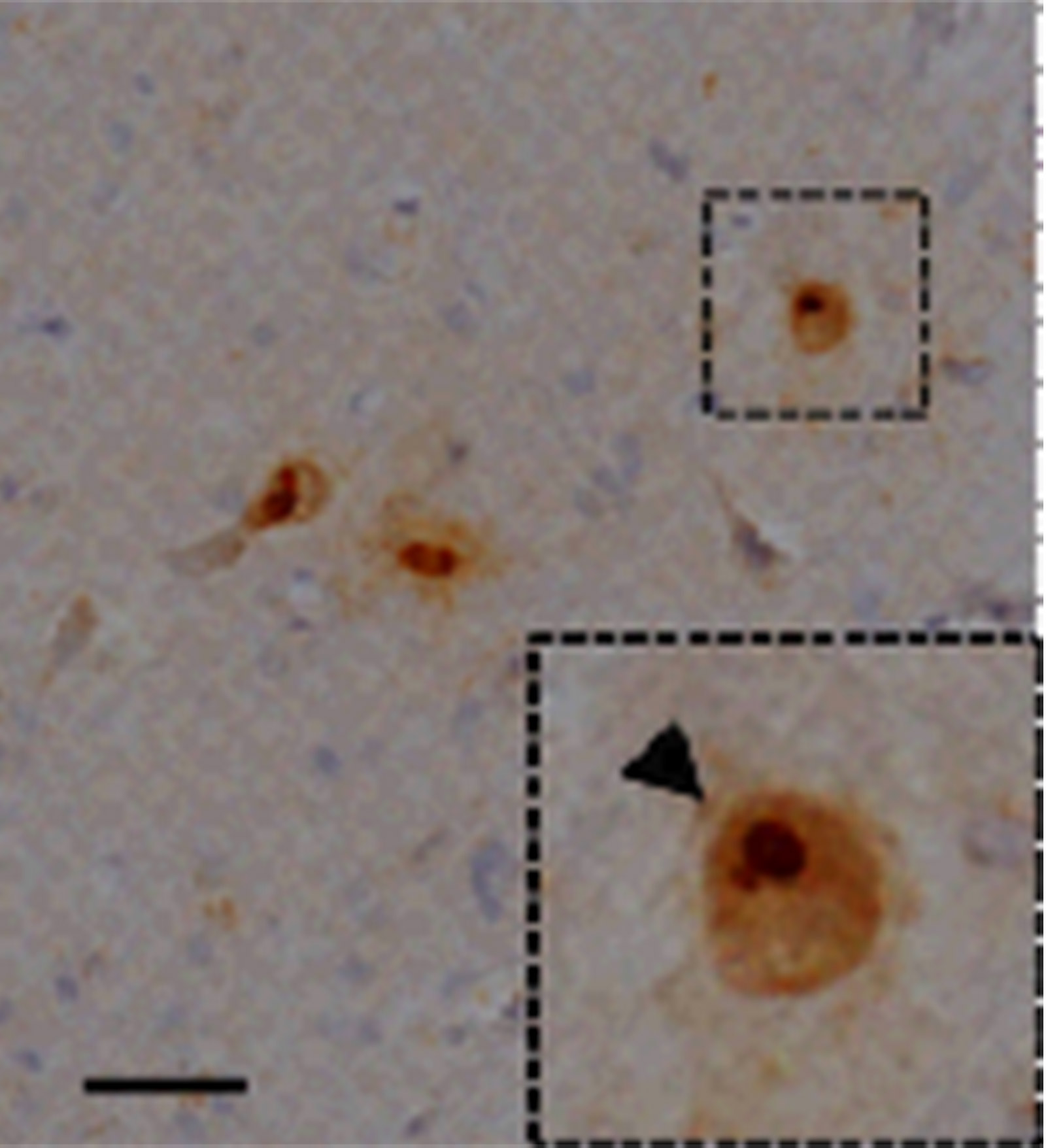
その結果、7頭の産仔が得られ、7頭全てにおいて変異遺伝子の導入が確認されました(図3)。このうち3頭において発症が確認され、発症に伴い、体重・握力・日内活動量の低下が認められました(図4)。また、運動失調の直接的原因となる小脳の細胞の異常(プルキンエ細胞の脱落)(図5)、頭部MRIでの第四脳室の拡大(図6)など、ポリグルタミン病の患者さんとよく似た病態も多く認められました。さらに、ヒトのポリグルタミン病に特徴的な脳病変である、ポリグルタミン蛋白質が蓄積して形成される封入体が、モデルマーモセットの脳内の神経細胞において確認されました(図7)。
これらの結果から、今回作出された遺伝子改変マーモセットがポリグルタミン病の患者さんとよく似た病態を示すことが明らかになりました。
研究の内容2:遺伝子改変コモンマーモセットの系統化に成功
ヒトの疾患に対する新たな診断法や治療法を開発するための橋渡し研究を行うためには、その疾患のモデルとなる実験動物の個体が複数必要であり、かつ、異なる個体どうしが同様の病態を示すことが望まれます。例えば、治療法の開発にあたっては、治療を行った群と行わなかった群の比較や、異なる個体で同程度の治療効果が認められるかという再現性の確認、治療群において副作用がないかなどについて、同様の病態を示す複数の個体を用いて調べる必要があるからです。
今回作出された遺伝子改変マーモセットモデルを将来の橋渡し研究に向けて実用化するためには、遺伝子改変技術で生まれた個体(第一世代)の子孫(第二世代)を作出し、系統化することが必要になります。第二世代の個体どうしは、第一世代の個体どうしよりもより近似した病態を示すことが知られています。NCNPでは、第一世代のうち、発症が確認された個体の精子を凍結保存し、顕微授精によって作出した受精卵を他のマーモセットの子宮に移植することにより、産仔の作出を試みました。その結果、現在までに5頭の産仔(第二世代)を獲得し、5頭全てにAtaxin 3遺伝子が確認されました。このことから、ポリグルタミン病モデルマーモセットの次世代作出が可能なことが証明されました。
期待されること
今回の研究によって、ポリグルタミン病に特徴的な症状や脳病変を再現した遺伝子改変モデルマーモセットの系統が世界に先駆けて作出されました。今後、このモデルマーモセットを用いた橋渡し研究を通じて、ポリグルタミン病や神経変性疾患に関する研究が進むことが期待されます。新たな治療法の開発にむけた研究だけでなく、病態の診断に有用なバイオマーカーや画像診断法を開発するための研究への応用も可能です。NCNP及び世界中の研究機関においてポリグルタミン病や神経変性疾患の病態や治療法に関する研究が進み、一日でも早く、同疾患に対する根本的な治療方法が確立することが期待されます。