.png)
てんかん発作悪化の治療ターゲットの発見 ~アストロサイトの分泌分子「Igfbp2」~
国立精神・神経医療研究センター(NCNP)神経研究所疾病研究第二部 小山隆太部長、東京大学 木下慎一大学院生(研究当時)、東京大学大学院薬学系研究科池谷裕二教授らと共同で、難治性てんかんである内側側頭葉てんかん(MTLE)モデルマウスの発作焦点である海馬において、アストロサイトが分泌する分子「Igfbp2」の産生が大きく増加していることを明らかにしました。さらに、アストロサイトにおけるIgfbp2産生を阻害することで、モデルマウスのてんかん発作が軽減されることも確認し、Igfbp2が発作悪化の原因因子として働くことを世界で初めて示しました。
また、今回の研究では、Igfbp2以外にも多数のアストロサイト由来分子が網羅的解析により同定され、将来的な治療ターゲットとなりうることも明らかになりました。本研究は、2025年11月15日に「GLIA」に掲載されました。
研究のポイント
- てんかん脳アストロサイトの網羅的遺伝子解析を実施:難治性てんかんの焦点である海馬のアストロサイトで、Igfbp2を含む多数の遺伝子の発現変動を検出。
- Igfbp2が神経の働きを“過剰に活性化”させることを発見:Igfbp2を神経回路に作用させると、神経細胞の興奮が増強されることを確認。
- Igfbp2を阻害すると、てんかん発作が軽減:アストロサイトでのIgfbp2産生を抑えることで、モデルマウスの発作が短く、軽くなることを実証。
- 今回得られた網羅的遺伝子データは“治療標的の宝庫”:Igfbp2以外にも、反応性アストロサイトに特異的に増減する多くの遺伝子が見つかっており、新規治療法の開発につながる可能性がある。
| アストロサイト由来因子Igfbp2がてんかんの病態形成に 関わることを世界で初めて発見 |
研究の背景
てんかんは、神経細胞が過剰に同時に興奮してしまうことで、けいれんや意識障害などの発作が繰り返し起こる慢性の脳の病気で、世界に約5,000万人の患者がいるとされています。この中でも、海馬(※1)を発作の起点とする「内側側頭葉てんかん(MTLE)」は、成人の難治性てんかんの多くを占めています。MTLEでは、約3割の患者が現在の抗てんかん薬では発作を十分に抑えられず、治療が難しいという課題があります。
MTLEに特徴的な変化として、海馬硬化と呼ばれる海馬の萎縮が知られています。海馬硬化が起きた海馬では、神経細胞(特に錐体細胞)が脱落する一方で、アストロサイト(※2)と呼ばれるグリア細胞が活性化し、「反応性アストログリオーシス」と呼ばれる状態を形成することがわかっています。
アストロサイトは、脳のエネルギー供給、イオンバランスの調整、免疫応答の調節、さらには血液脳関門(※3)の形成など、脳の正常な働きを支える多くの役割を担っています。近年、こうしたアストロサイトが反応性アストログリオーシスへと変化することで、てんかんの発症や進行に関わっている可能性が指摘されるようになってきました。しかし、アストロサイトのどのような変化が、どのような仕組みでてんかんの病態に関与するのかといった具体的なメカニズムは、これまで明らかになっていませんでした。
そこで本研究では、MTLEモデルマウスの海馬に存在するアストロサイトを対象に網羅的な遺伝子発現解析を行い、反応性アストログリオーシスが起きたアストロサイトの特徴を詳しく調べることを目的としました。これにより、てんかんの進行に関わるアストロサイト由来の因子を明らかにすることを目指しました。
研究の概要
本研究では、MTLEモデルマウスを用いて、反応性アストログリオーシスを形成した海馬アストロサイト(=反応性アストロサイト)の遺伝子発現を網羅的に解析しました。これにより、てんかんの病態形成に関わるアストロサイト由来分子の実態を明らかにすることを目指しました。
反応性アストロサイトで Igfbp2 の産生が増加していることを発見
まず研究グループは、カイニン酸(※4)という痙攣を引き起こす薬剤をマウスの海馬に投与することで、内側側頭葉てんかん(MTLE)を再現したモデルマウスを作製しました。このモデルでは、MTLEで見られる神経細胞死や反応性アストログリオーシスといった海馬硬化の特徴が再現されます。
次に、このモデルマウスを使って、反応性アストロサイトに特異的に起きている遺伝子変化を網羅的に解析しました。そのために、アストロサイトに遺伝子を導入できる**アデノ随伴ウイルス(AAV)ベクター(※5)と、細胞内で翻訳中のRNAを回収するTRAP法(※6:Translating Ribosomal Affinity Purification)という手法を組み合わせ、反応性アストロサイトだけの遺伝子情報を高精度に取得することに成功しました。
この解析の結果、反応性アストロサイトでは「Igfbp2(※7)」という分子の産生が大きく増加していることが分かりました。さらに、Igfbp2は主に反応性アストロサイトから産生されていること、そして、そのIgfbp2産生の増加は長期間にわたって持続することも明らかになりました。
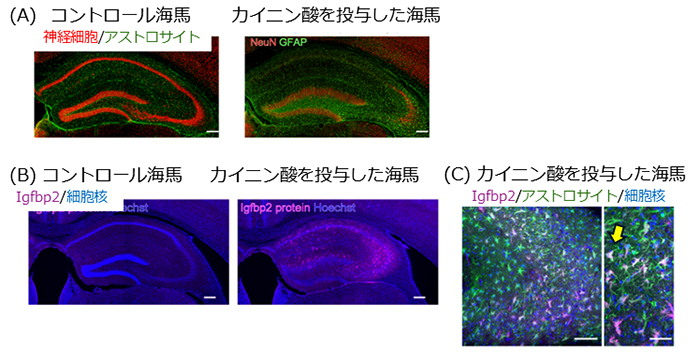
| 図1:MTLEモデルマウス海馬におけるIgfbp2発現 (A) カイニン酸を投与したマウスの海馬では、**神経細胞が死んで萎縮し、アストロサイトが活性化して集まる(反応性アストログリオーシス)**といった、MTLEに特徴的な構造変化が見られる。(Scale bar = 200 µm) (B) Igfbp2 の量を比較すると、カイニン酸を投与した海馬では Igfbp2が大幅に増えていることが確認できる。 (Scale bar = 200 µm) (C) Igfbp2 は アストロサイトと同じ場所に存在しており(共局在)、アストロサイトがIgfbp2を産生していることを示している。(Scale bar = 50 µm) |
反応性アストロサイトが産生するIgfbp2がてんかん発作を悪化させることを確認
まず研究グループは、Igfbp2が神経細胞の興奮にどの程度影響するのかを調べるために、マウスの海馬から作製した培養切片にIgfbp2を加え、神経活動を記録しました。その結果、Igfbp2を加えると神経活動が明らかに活性化することが分かりました。これは、てんかん発作の原因である“神経細胞の過剰興奮”にIgfbp2が関わっていることを示しています。次に、実際のてんかんモデルでの作用を調べるため、MTLEモデルマウスを使って、反応性アストロサイトが産生するIgfbp2を遺伝学的に阻害しました。MTLEモデルマウスでは、カイニン酸投与後に数週間の潜伏期間を経て自発的なてんかん発作が起こるようになります。このマウスでIgfbp2の産生を抑えると、発作1回あたりの持続時間が短くなることや、観察時間全体のうち発作に費やされる時間の割合が減ること、といった改善が見られました。
これらの結果は、反応性アストロサイトが産生するIgfbp2が、てんかん発作を悪化させる要因として働いていることを示唆しています。さらに、反応性アストロサイトから取得した網羅的遺伝子データを解析したところ、Igfbp2の産生を促す「BMP6–pSMAD」と呼ばれるシグナル経路が活性化している可能性も明らかになりました。
以上の研究結果から、難治性てんかんであるMTLEモデルマウスでは、反応性アストロサイトが産生するIgfbp2が神経活動を活性化し、てんかんの病態形成に関与する可能性があることが示されました。
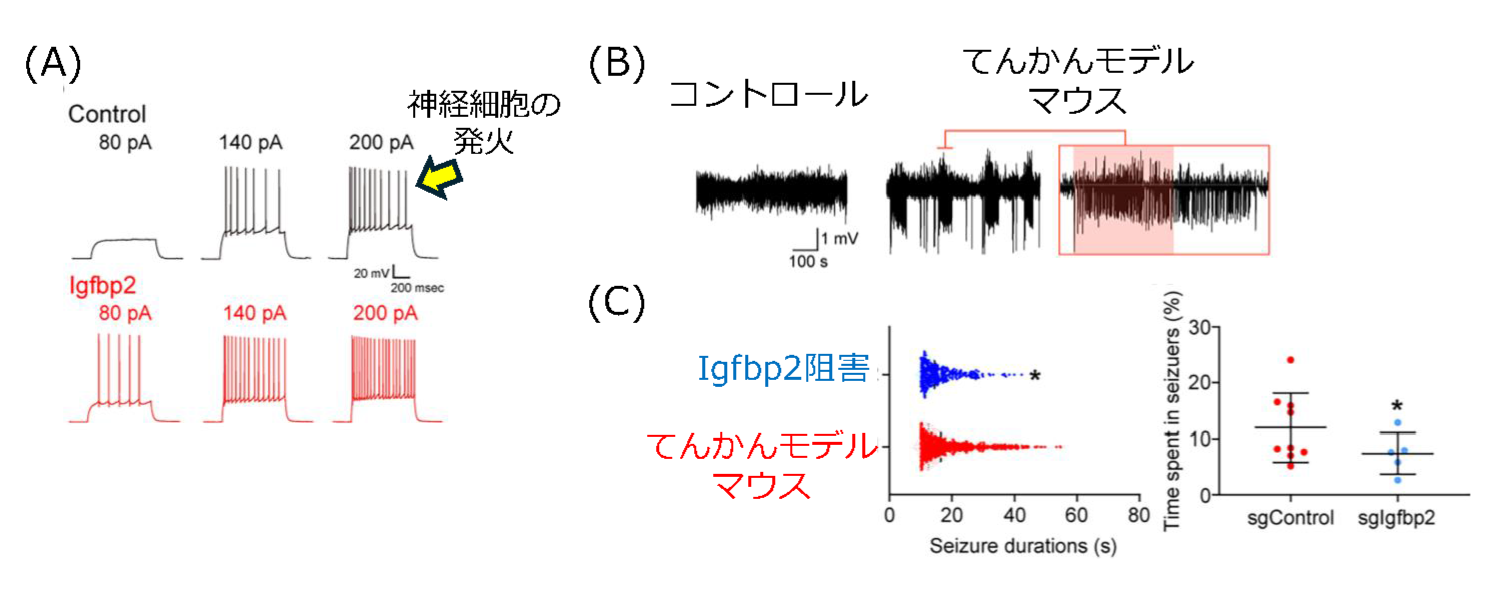
| 図2:Igfbp2の阻害はてんかん発作を抑制する (A)海馬切片に Igfbp2 を加えると、神経活動(神経細胞の発火)が増加する。図の一つ一つの線は、神経細胞が電気的に活動している様子を示している。 (B)てんかんモデルマウスでは、自発的なてんかん発作(赤色でハイライトした部分)が記録される。 (C)反応性アストロサイトが産生する Igfbp2を阻害すると、1回あたりのてんかん発作の持続時間が短くなり、発作が軽減することが分かった。 |
今後の展望
本研究では、反応性アストロサイトで産生が増えるIgfbp2というアストロサイト由来分子を特定し、これが神経細胞の活動を高め、てんかん発作を悪化させる可能性があることを示しました。近年、アルツハイマー病やグリオーマなど、てんかんを合併しやすい疾患でもIgfbp2が増えることが報告されており、本研究はアストロサイトを標的とした新しい治療法の開発につながる可能性を示しています。
また今回は、反応性アストロサイトに特異的な網羅的遺伝子発現データを取得しました。このデータを活用することで、Igfbp2以外にも、反応性アストロサイトを介しててんかん病態に関わる新たな分子やシグナル経路を将来的に発見できる可能性があります。これにより、反応性アストロサイトを狙った新しい治療戦略の開発が今後さらに進むことが期待されます。
用語解説
※1 海馬:
記憶の形成に深く関わる脳の領域の一つ。内側側頭葉てんかん(MTLE)では、この海馬が発作の出発点になることが多い。
※2 アストロサイト:
神経細胞を支える「グリア細胞」の一種。脳内では、神経活動の調整、炎症反応の制御、栄養供給など多くの役割を担っている。てんかんや神経疾患でも重要な働きを持つことが分かってきている
※3 血液脳関門(BBB):
血液中にある有害物質が脳の中に入り込まないように守る“関所”のような仕組み。脳を外部環境から守るための重要なバリア機構。
※4 カイニン酸:
海藻の一種「マクリ」から見つかった物質で、神経細胞を過剰に興奮させる作用を持つ。動物モデルでてんかんを再現するための代表的な薬剤として用いられる。
※5 アデノ随伴ウイルス (AAV)ベクター:
遺伝子を細胞へ運ぶための「運び屋(ベクター)」として利用されるウイルス。病原性がほとんどなく、安全性が高いことから広く研究に使われる。導入する遺伝子を工夫することで、特定の細胞だけに遺伝子を発現させることができる。
※6 Translating Ribosomal Affinity Purification(TRAP)法:
リボソーム(タンパク質を作る細胞小器官)に結合した翻訳中のmRNAだけを回収する手法。細胞が“今まさに作ろうとしているタンパク質”の情報を抽出できるため、特定の細胞の活動状態を詳細に調べることができる。
原著論文情報
論文名:Astrocytic Igfbp2 Promotes Spontaneous Seizures in a Mouse Model of Mesial Temporal Lobe Epilepsy
著 者:Shinichi Kinoshita, Nobuyoshi Matsumoto, Shota Morikawa, Yuji Ikegaya, Ryuta Koyama*
掲載誌:GLIA
DOI:https://onlinelibrary.wiley.com/doi/10.1002/glia.70099
研究費情報
本研究結果は、以下の日本学術振興会・科学研究費補助金 (20H05897:小山; 22K02135: 池谷)、日本医療研究開発機構 (JP23jf0126004, JP24wm0625114, JP25wm0625518:小山; 22gm1510002: 池谷)、科学技術振興機構 (JPMJPR18H4, JPMJCR24B6: 小山;JPMJER1801:池谷)などの支援を受けて行われました。
参考リンク
神経研究所
https://www.ncnp.go.jp/neuroscience/index.php
疾病研究第二部
https://www.ncnp.go.jp/nin/guide/r2/




