
世界初 環境中のナノ粒子から脳を守る「防御システム」を解明
~微小粒子が引き起こす脳の神経毒性に対する保護メカニズムをマウスで発見~
国立精神・神経医療研究センター(NCNP)神経研究所疾病研究第二部 小山隆太部長、大柿安里研究員、東京大学大学院薬学系研究科 池谷裕二教授らと共同で、大気中の微小粒子「PM2.5」に含まれるナノサイズの人工物質(非生物由来ナノ粒子)がマウスの脳に侵入した際、複数の脳細胞がそれを感知し協調して処理し、脳を守る“防御システム”が存在することを世界で初めて発見しました。
このメカニズムは、脳内の血管、血管近傍のアストロサイト、脳内免疫細胞であるマイクログリアが連携し、毒性のあるナノ粒子を効率的に除去する働きを持ちます。この防御機能が働かないと、神経細胞の死や、不安のような行動異常が悪化することもマウスで確認されました。本研究は、2025年7月14日に「Journal of Neuroinflammation」に掲載されました。
研究のポイント
1. ナノ粒子の脳内侵入と蓄積部位を特定:PM2.5に含まれるナノ粒子が発達期の脳に侵入し、主に視床・視床下部に蓄積することを発見。
2. マイクログリアがナノ粒子を貪食:脳の免疫細胞マイクログリアが、侵入ナノ粒子を優先的に取り込むことを解明。
3. 細胞連携による取り込みメカニズムの解明:血管内皮細胞→アストロサイト→マイクログリアという細胞間連携と、補体・ケモカインによる貪食促進機構を初めて明らかに。
4. 脳の防御システムとしての役割を証明:この貪食が神経細胞を守る防御システムであることを実証。

環境ナノ粒子に対して、複数の脳細胞が協調して防御する
システムの存在を世界で初めてマウスで発見
研究概要図(イメージ)
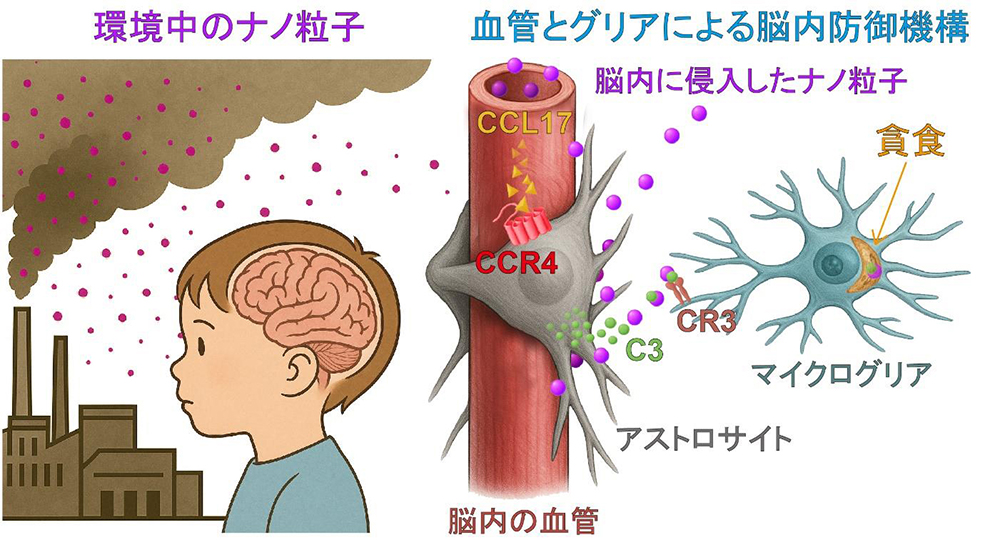
| 図1:本研究の概要:脳を守る細胞間の連携システムを発見。 大気中のPM2.5に含まれるナノ粒子は、血液を通じて脳に侵入することがあります。本研究では、これらのナノ粒子に対し、脳の血管とグリア細胞(アストロサイトとマイクログリア)が連携して脳を守るメカニズムがあることを明らかにしました。 具体的には、以下のような細胞間の協力が確認されました: 1. ナノ粒子が脳内に入ると、血管が“警報物質”であるケモカインCCL17を放出。
この一連の連携が、ナノ粒子による神経細胞の障害や不安行動などの悪影響を防ぐ「防御システム」として働いていることが確認されました。なお、この細胞間の連携のどこかがうまく働かなくなると、神経細胞の死や行動異常が悪化することもわかっています。2. 血管の近くにいるアストロサイトが、CCR4受容体でCCL17を感知し、“タグ”となる補体C3という物質を分泌。 3. 補体C3がナノ粒子に付着し、「これは処理すべき異物」という目印となる。 4. 脳内のマイクログリアが、CR3受容体でこのタグを認識してナノ粒子を取り込み、処理(貪食)する。 |
研究の背景
近年、世界的に大気汚染が深刻化しており、その主要な原因である黄砂やマイクロプラスチックなどに含まれる微小粒子 (Particulate Matter 2.5; PM2.5)が、健康に悪影響を及ぼすことが社会的な問題となっています。これらの粒子の主な成分は、黄砂に含まれるシリカ(ケイ素化合物)や、プラスチック製品に由来するポリスチレンなどの「非生物由来物質」です。とくに、直径がナノメートル(百万分の1メートル)オーダーの“ナノ粒子”は非常に小さく、呼吸によって体内に入り、血液を通じて全身の臓器に届きます。最近の研究では、これらのナノ粒子が最終的に脳にまで到達することが明らかになっています。
脳に蓄積したナノ粒子は、神経の炎症、記憶力や学習力の低下、不安や気分の異常など、さまざまな神経・精神の不調に関わっている可能性が指摘されています。とくに注意が必要なのは、発達段階にある子どもの脳です。子どもの脳は、血液から有害物質が侵入するのを防ぐ“血液脳関門(BBB)”が未発達であり、ナノ粒子の影響を受けやすいと考えられてきました。しかし、これまでのところ、脳がこうした非生物由来のナノ粒子に対して、どのように自らを守っているのか(防御システム)や、そのメカニズムについては、詳しくわかっていませんでした。
そこで本研究では、発達期のマウスにナノ粒子を投与するモデルを作り、脳内での粒子の動き(動態)や、脳内の細胞がどう反応するか(細胞応答)を詳細に解析することで、脳がどのようにしてナノ粒子から自らを守っているのかを明らかにすることを目指しました。
研究の概要
本研究では、環境中に広く存在する非生物由来のナノ粒子(シリカやポリスチレンなど)が、発達期の脳に侵入したときに、脳内でどのような反応が起こるのかを明らかにしました。ナノ粒子はすでにヒトの脳内でも検出された例があり、多くは呼吸によって体内に入り、血液を通して脳に届くと考えられています。このメカニズムを再現するために、本研究では、蛍光で可視化できるシリカ粒子やポリスチレン粒子(いずれも非生物由来のナノ粒子)を、生後14~20日のマウス(人でいうと乳幼児~小児期に相当)に皮下投与し、その後、ナノ粒子がどこに分布し、どのように脳の細胞が反応するかを詳しく観察しました。なお、この実験で使用したナノ粒子の投与量は、1日あたりの曝露では人の環境曝露を上回るよう設定しました。しかし総投与量としては、子どもの長期的な曝露量よりも低く、実験的に脳内の免疫応答を評価するのに適した条件です。
1. 非生物由来ナノ粒子は脳内に侵入し、マイクログリアによって“食べられる”ことを発見
蛍光で標識したシリカナノ粒子を発達期のマウスに投与し、脳を詳しく観察した結果、これらの環境中のナノ粒子が、血液脳関門(※1)を通過して脳の中に入り込むことが明らかになりました。とくに、視床や視床下部といった、感覚や情動(気分や感情)の制御に関わる重要な脳の部位にナノ粒子が多く集まることがわかりました。これらの部位は、環境ストレスによる脳機能障害や行動の異常とも深く関わるため、ナノ粒子が子どもの脳に与える影響の大きさが示唆されます。次に、こうしたナノ粒子に脳の細胞がどう反応しているかを調べたところ、マイクログリア(※2)と呼ばれる脳内の免疫細胞が活発に反応し、ナノ粒子を取り込んでいることが確認されました(図2)。さらに詳しく調べると、ナノ粒子は主にマイクログリアに取り込まれ、その内部で処理されている(貪食されている)ことがわかりました。
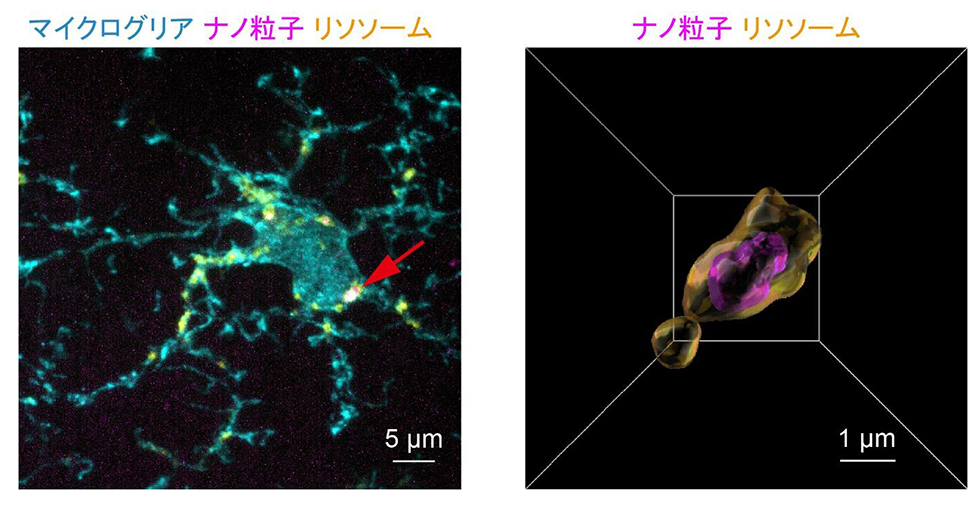
| 図2:ナノ粒子を取り込む脳内の免疫細胞(マイクログリア) (左)マウスの脳内で、免疫を担うマイクログリアが、環境中に存在するシリカナノ粒子を取り込み、細胞内の“分解工場”にあたるリソソームへと運んでいる様子を示しています(矢印)。 (右)左図の矢印で示した部分を拡大した画像で、リソソームの内部(茶)にシリカナノ粒子(紫)が取り込まれている様子が確認できます。 |
さらに、このようなナノ粒子をマイクログリアがどのように認識して取り込んでいるのかを調べるため、黄砂に含まれるナノ粒子のモデルとして、シリカナノ粒子を用いました。タンパク質を含まない非生物由来物質に対する取り込み機構はこれまで不明でしたが、私たちは、生体内での異物処理に関与する補体系(※3)に着目しました。その結果、補体分子C3がシリカナノ粒子に結合し、マイクログリアがC3受容体を介してこれらの粒子を認識し、取り込んでいることがわかりました。取り込まれた粒子はリソソーム (※4)と呼ばれる細胞内の“分解工場”に送られ、処理されていました。また、別種のナノ粒子であるポリスチレンナノ粒子 (マイクロプラスチックのモデル)でも同様の取り込みが確認され、さらに実際の吸入経路に近い経肺投与(肺を通じた投与)においても同様の反応が見られたことから、マイクログリアは粒子の種類や経路に関わらず、脳内に侵入した非生物由来ナノ粒子を処理する重要な働きを担っていることが示されました。
2. 血管とアストロサイトのシグナルが、マイクログリアによるナノ粒子の処理を後押しする
補体C3がナノ粒子に付着することでマイクログリアがそれを認識し、貪食するメカニズムがあることがわかりましたが、「そもそもC3はどこで作られるのか?」という疑問が浮かびます。
詳しく調べた結果、C3は主に血管の周囲に存在するアストロサイト(※5)というグリア細胞で作られていることがわかりました。さらに解析を進めると、ナノ粒子にさらされた血管内皮細胞がCCL17というケモカイン(※6)を放出し、それを近くのアストロサイトがCCR4という受容体で受け取ることで、アストロサイトがC3を多く分泌するという一連の細胞間のシグナル伝達が明らかになりました。
この結果は、脳の防御が単なる「マイクログリアがナノ粒子を飲み込む」という単純な反応ではなく、血管・アストロサイト・マイクログリアが連携して働くことによって成り立っていることを示しています。環境中のナノ粒子に対して、脳が持つ高度な免疫防御システムの一端が明らかになったのです。
3. マイクログリアの働きが、ナノ粒子による脳のダメージを防ぐ
これまでの結果から、マイクログリアが非生物由来ナノ粒子を処理する働きがあることがわかりました。では、その働きが止まったとき、脳にはどのような影響が起こるのでしょうか?
私たちは、ケモカイン–補体シグナルを抑えることで、マイクログリアによるナノ粒子の取り込みを抑制したマウスの脳を調べました。すると、神経細胞の数が大きく減ってしまうことが明らかになりました。逆に、ナノ粒子を投与していてもマイクログリアが正常に取り込みを行っているマウスでは、神経細胞の減少が軽く抑えられていました。
さらに、不安を評価する実験でも、マイクログリアの取り込みが抑えられていたマウスでは、通常よりも不安行動が強くなっていることが確認されました。
これらの結果は、マイクログリアによるナノ粒子の取り込みが、単なる掃除ではなく、「脳を守るための防御反応」そのものであることを示しています。環境中に存在するナノ粒子が脳に及ぼす悪影響を、マイクログリアが積極的に和らげているという重要なメカニズムが明らかになったのです。
今後の展望
特に、補体C3やアストロサイトのCCR4受容体といった分子シグナルを標的とした介入が、ナノ粒子による脳障害を予防・軽減する新たな治療戦略となる可能性が示されました。将来的には、これらを利用した神経疾患への応用も視野に入っています。
さらに今後は、ヒトの日常的な環境曝露に近い、長期的かつ低用量のモデルを使った研究や、人の脳への影響の検証も進めていきます。これにより、実生活レベルでの環境対策や公衆衛生政策にも貢献できると考えています。
用語説明
※1 血液脳関門(BBB):血液中の有害物質が脳内に入らないようにする“関所”のような構造。発達初期はこの機能がまだ完全ではない。
※2 マイクログリア:脳の中に常在する免疫細胞。異物や老廃物を感知して取り込み、分解する「脳の掃除屋」として働く。
※3 補体系(補体):体内の異物を認識し排除するために働く、免疫システムの一部。補体分子C3は、異物の表面に結合して“目印”のような働きをし、免疫細胞による貪食を助ける。
※4 リソソーム:細胞の中にある小さな袋状の構造で、不要になった物質や取り込んだ異物を分解する働きを持つ。酵素が多く含まれており、「細胞内の消化器官」とも呼ばれ、細胞が異物を取り込んだ際には、リソソーム内でそれを分解・処理する。
※5 アストロサイト:神経細胞を支えるグリア細胞の一種で、脳内の物質輸送や炎症応答にも関わる。
※6 ケモカイン:細胞を誘導したり活性化させたりする信号物質の一種。CCL17はその一種で、免疫応答を調節する働きがある。
原著論文情報
論文タイトル:Chemokine–complement cascade in glial–vascular units protects neurons from non-biogenic nanoparticles
著者:Ari Ogaki, Shinichi Kinoshita, Yuji Ikegaya, Ryuta Koyama*
掲載誌:Journal of Neuroinflammation
https://doi.org/10.1186/s12974-025-03475-7
研究費情報
本研究結果は、以下の日本学術振興会・科学研究費補助金 (20H05897:小山; 22K2135: 池谷)、日本医療研究開発機構 (JP24jf0126004s0402, JP24wm0625114h0001 :小山; 22gm1510002h0002: 池谷)、科学技術振興機構 (JPMJPR18H4, JPMJCR24B6:小山;JPMJER1801:池谷)などの支援を受けて行われました。
参考リンク
神経研究所
https://www.ncnp.go.jp/neuroscience/
疾病研究第二部
https://www.ncnp.go.jp/nin/guide/r2/




