2019年5月16日
国立研究開発法人 国立精神・神経医療研究センター (NCNP)
日本医科大学
国立研究開発法人 日本医療研究開発機構(AMED)
国立研究開発法人 国立精神・神経医療研究センター(NCNP、東京都小平市、理事長:水澤英洋)神経研究所(所長:和田圭司)疾病研究第2部(部長:後藤雄一)の李コウ研究員や井上健室長らの研究グループは、小児の難病である先天性大脳白質形成不全症(脳の中の髄鞘(ミエリン)ができない遺伝性の病気)の代表的疾患ペリツェウス・メルツバッハ病(PMD)に対する新しい遺伝子治療法を開発しました。PMDは、PLP1遺伝子の異常が原因で、脳の中の髄鞘(ミエリン)がうまく作られないために、生後間もなく運動および認知の発達が止まり、痙性対麻痺や失調、ジストニア、眼振などの症状が見られる重篤な小児神経難治性疾患です。わが国での患者数は100〜200人ほどと推定されている希少性疾患です。今回、治療法開発した技術は、遺伝子発現を抑制する作用を持つ人工マイクロRNA(人工miRNA)をアデノ随伴ウイルス(AAV)という遺伝子の運び屋(ベクター)に組み込んで脳の中の細胞に運び込み、病気の原因となっている特定遺伝子の過剰発現を修正するというものです。この遺伝子治療を行った病気のモデルマウスでは、寿命が伸び、症状が改善し、髄鞘(ミエリン)が作られるようになるなど顕著な治療効果が観察されました。この手法は、これまで遺伝子治療が困難と考えられてきた脳のグリア細胞(オリゴデンドロサイト)に、高い効率でmiRNAを運び込むことができる画期的な方法です。今後、臨床応用を目指した治療法開発が期待されます。本研究は、NCNP神経研究所と日本医科大学生化学/分子生物学(岡田尚巳教授)との共同研究として、AMEDなどの支援によって行われたもので、研究成果は、日本時間2019年5月16日(木)午後10時(報道解禁日時:米国東部標準時(夏時間)2019年5月16日午前9時)に『JCI Insight』オンライン版に掲載されました。
研究の背景
近年、遺伝子解析技術の進歩により多くの遺伝性疾患の原因が明らかになってきましたが、治療法がある疾患はまだほんのわずかです。PMDを代表とする先天性大脳白質形成不全症も同様で、これまで治療法がありませんでした。PMDは、PLP1という遺伝子の異常により、大脳をはじめとする中枢神経系全体の髄鞘(ミエリン)を正常に作れないことが原因で起こる疾患で、運動と認知両面での発達の著明な遅れと様々な神経学的症状が見られる小児希少性神経難病の1つです。髄鞘(ミエリン)は神経細胞からの電気信号を次の神経細胞に伝える軸索を何重にも巻いている膜様の構造物で、これがうまく形成されないために脳の機能が著明に低下してしまう病気がPMDです。PMDを引き起こす遺伝子変異のうち、最も頻度が高いのはPLP1遺伝子のゲノム重複で、正常なPLP1遺伝子の数が1個から2個に増えるため、PLP1のメッセンジャーRNA(mRNA)が増え、さらにPLP1のタンパク質が過剰に作られることが疾患の原因であると考えられています。そこで私たちは、この過剰なPLP1の発現を低下させる遺伝子治療法を開発できれば、この疾患を治療できるのではないかと考えました(図1)。
図1.PMDの原因と遺伝子治療の模式図
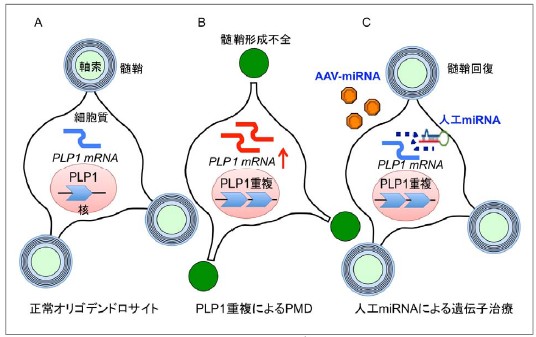
図は、脳の髄鞘を作るオリゴデンドロサイトを示しています。オリゴデンドロサイトでは、PMDの原因遺伝子であるPLP1が発現しています(A)。通常は1個しかないPLP1遺伝子の数が2個に増えると(PLP1重複)PLP1のmRNAの発現量が増加し、そのために髄鞘をうまく作れなくなります(B)。そのため、神経細胞からの信号を伝える軸索の機能が低下してしまう病気がPMDです。そこで、PLP1に特異的な人工miRNAを設計し、これをAAVベクターに組み込んで、オリゴデンドロサイトに送り届ける治療を行うと、過剰なPLP1のmRNAを分解することができ、その結果、正常な髄鞘(ミエリン)に回復することができます(C)。
研究の内容
まず私たちは、特異的かつ高い効率でPLP1遺伝子の発現を低下させることができる遺伝子治療の技術の開発を行いました。ここでは、人工miRNAの使用と髄鞘を作る細胞であるオリゴデンドロサイトに特異的なプロモーターの開発が重要な要因でした。この2つを、近年、遺伝子治療のベクターとして実用化の期待が高くなっているAAVベクター(自然界に存在する無毒のウイルスを改変して、任意の遺伝子を組み込んで細胞に運び入れることができるようした合成のウイルス)に組み込みました。
人工miRNAは、特定の遺伝子のmRNAを分解することで発現を低下させることができるツールです。通常、生体内にあるmiRNAは複数の遺伝子の発現を低下させますが、特定の遺伝子に特有の配列(例えば今回はPLP1遺伝子)を用いてmiRNAを作ると、標的の遺伝子のみの発現を低下させることができます。さらに人工miRNAは標的の細胞だけで発現するようにコントロールすることで、不特定の細胞に効果が及ぶことを防げます。今回、オリゴデンドロサイトだけで人工miRNAを発現させるために用いたのが、新規に設計したオリゴデンドロサイト特異的プロモーターです。驚くことに、このプロモーターの使用により、これまでAAVベクターによる遺伝子治療が困難と考えられていたオリゴデンドロサイトで、非常に高い特異性と効率性で遺伝子を導入することができるようになりました。
この新規に設計したオリゴデンドロサイト特異的プロモーターを使い、人工miRNAをオリゴデンドロサイトだけで発現することができるようにしたPLP1特異的遺伝子発現抑制AAVベクター(scAAV.CNP.Venus.Plp1miRNA)を野生型のマウスの脳に直接投与したところ、脳の中の広い範囲に拡散し、オリゴデンドロサイト特異的にPLP1遺伝子の発現を効果的に低下させることができることがわかりました。次にPMDのモデルマウスであるPLP1トランスジェニックマウスの脳に投与したところ、通常生後40日までに全て死亡するマウスが、最大76日まで寿命が延長し、体重も維持できることがわかりました。これらのマウスの脳を観察すると、オリゴデンドロサイトに異常蓄積していたPLP1が消え、オリゴデンドロサイトの数も増え、変性している細胞の数も減ることがわかりました。髄鞘に特異的な他のタンパク質の発現が回復し、髄鞘の形や厚さも回復することがわかりました(図2)。またこの治療効果に伴って、脳の中に起こっていた炎症反応(グリオーシスやミクログリアの活性化)も抑えられていました。これらの治療効果の結果、マウスの運動機能も回復していることがわかりました。
図2.正常マウスとPMDモデルマウスの脳の髄鞘(ミエリン)の電子顕微鏡の写真
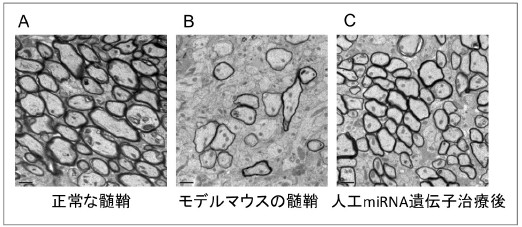
正常なマウスの脳では、髄鞘がたくさんの軸索(円形の白っぽい部分)の周りに厚く巻いています(黒っぽい部分)(A)。未治療のモデルマウスでは、髄鞘が巻いている軸索の数が極端に少なくなっており、巻いていてもその厚さが薄いことがわかります(B)。一方、人工miRNAを用いた遺伝子治療を行なったモデルマウスでは、髄鞘が巻いている軸索の数と厚さが回復していることがわかります(C)。
今後の展望
本研究成果により、これまで治療法がなかったPMDに初めて治療ができる可能性が出て来ました。AAVベクターを用いた遺伝子治療は、現在、様々な難治性遺伝性疾患に対する治療法として開発が進んでおり、これまで治療が困難であった疾患の患者さんへの光明となることが期待されています。今回の研究では、過剰な遺伝子の発現を人工miRNAで低下させて治療するという新たなアプローチを用いたこと、これまで遺伝子治療が困難と考えられてきたオリゴデンドロサイトを標的とした遺伝子治療を可能にしたことが大きな成果です。今後は、PMDの患者さんの治療に向けてこの遺伝子治療法を実用化するために、より安全かつ効果的なものに改善させていく必要があります。さらに、この技術を応用することで、これまでの遺伝子治療では対象外とされ、治療法が見つかっていない多くの疾患の治療法開発が可能になると期待されます。
用語解説
髄鞘(ずいしょう、ミエリン)
脳の中の神経細胞と神経細胞を繋ぐ軸索の周りを巻いている膜構造物で、電気信号の絶縁体として機能する。髄鞘はオリゴデンドロサイトというグリア細胞の一部分で、オリゴデンドロサイトに何らかの障害が起きて、髄鞘ができなくなる疾患が先天性大脳白質形成不全症である。
ペリツェウス・メルツバッハ病(PMD)
PLP1遺伝子の異常が原因で、脳の中の髄鞘がうまく作られないために、生後間もなく運動および認知の発達が止まり、痙性対麻痺や失調、ジストニア、眼振などの症状が見られる。重篤な小児神経疾患である先天性大脳白質形成不全症の代表的疾患。PMDを含め本邦に200名あまりの先天性大脳白質形成不全症の患者がいると推定されている。
人工マイクロRNA(人工miRNA)
人工的に設計された21~23塩基鎖長の機能性RNA。特定の遺伝子のメッセンジャーRNA(タンパク質をコードするRNA)を標的とし、その翻訳(タンパク質合成)を制御することによって遺伝子の発現を抑制することができる。
アデノ随伴ウイルス(AAV)
自然界に存在し、人間には無毒な小さなウイルス。野生型をベクターに改変した場合には、ウイルスDNAが核DNAに挿入されないこと、非分裂細胞にも感染できることから、近年遺伝子治療における有用性が注目されている。
トランスジェニックマウス
ある特定の遺伝子を過剰発現するように操作されたマウス。ヒトの疾患モデルとして、有用である。
原論文情報
- 論文名:Gene suppressing therapy for Pelizaeus-Merzbacher disease using artificial miRNA.
- 著者:Heng Li, Hironori Okada, Sadafumi Suzuki, Kazuhisa Sakai, Hitomi Izumi, Yukiko Matsushima, Noritaka Ichinohe, Yu-ichi Goto, Takashi Okada, Ken Inoue.
- 掲載誌:JCI Insight, 2019;4(10):e125052
- DOI:doi.org/10.1172/jci.insight.125052
- URL:https://doi.org/10.1172/jci.insight.125052
助成金
本研究成果は、以下の補助金・事業・助成金によって行われました。
- 国立研究開発法人 日本医療研究開発機構(AMED)の難治性疾患実用化研究事業「遺伝性髄鞘形成不全の病態に基づく革新的な治療法の開発のための研究」(16ek0109016h0003)
- 文部科学省科学研究費補助金 基盤研究(B)(16H05361)および基盤研究(C)(16K19679)
お問い合わせ先
【研究に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター
神経研究所 疾病研究第2部 室長 井上 健(いのうえ けん)
TEL: 042-346-1713 FAX: 042-346-1743
E-mail:![]()
【報道に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター 総務課 広報係
〒187-8551 東京都小平市小川東町4-1-1
TEL: 042-341-2711(代表) FAX: 042-344-6745
日本医科大学学事部庶務課 吉村
〒113-0022 東京都文京区千駄木1-1-5
TEL:03-8-3822-2131 FAX:03-3822-8575
E-mail:![]()
【AMED事業に関するお問い合わせ】
日本医療研究開発機構 戦略推進部 難病研究課
〒100-0004 東京都千代田区大手町1-7-1
電話:03-6870-2223
Eメール:![]()



