2019年6月27日
国立研究開発法人 国立精神・神経医療研究センター (NCNP)
国立研究開発法人 国立精神・神経医療研究センター(NCNP、東京都小平市、理事長:水澤英洋)神経研究所(所長:和田圭司)客員研究員(前疾病研究第6部室長)荒木 亘らの研究グループは、アルツハイマー型認知症の発病の要となるアミロイドベータタンパク質(Aβ)オリゴマーの神経毒性の低減を介して、病態を改善する効果を持つ植物由来の新しい治療・予防薬候補物質を発見することに成功しました。
アルツハイマー型認知症(アルツハイマー病)は、患者数の最も多い認知症疾患です。しかし、まだその治療は対症的なものに留まっています。この疾患においては、脳内に異常タンパク質であるAβが蓄積することが特徴ですが、最近、Aβの集合体であるAβオリゴマーが神経細胞のシナプスなどを障害し、病気の引金として働くことが明らかになってきました。
今回、研究グループは、神経細胞モデルを用いた研究によって、植物成分からAβオリゴマーの毒性を抑制する物質「チロソール」を同定しました。さらに、この物質をアルツハイマーモデルマウスに長期経口投与することにより、シナプス障害や酸化ストレス病態が改善するといった神経保護的効果が現れるとともに、認知障害が回復することを示しました。すなわち、チロソールはAβオリゴマーの持つ神経毒性を低減することによって、アルツハイマー病の病態を改善する効果を有する治療薬候補物質と考えられます。この研究成果は、アルツハイマー病の治療薬開発において、新たな方向性を開くという点で、大きな意義を持つものといえます。
本研究は、NCNP(疾病研究第6部、同第2部、第4部、病院)と、(株)常磐植物化学研究所、筑波大学、東京理科大学、東京都医学総合研究所との共同研究として行われたもので、研究成果は、日本時間2019年6月22日に、国際科学雑誌「Journal of Alzheimer’s Disease」オンライン版に掲載されました。
研究の背景
アルツハイマー型認知症(アルツハイマー病)は、記憶などの認知機能の異常を主症状とする疾患で、その国内患者総数は250万人以上と推定され、人口の高齢化とともに、著増しつつあります。この疾患では、脳内に異常タンパク質であるアミロイドベータタンパク質(Aβ)が線維化して塊(老人斑)となって蓄積することが特徴です。しかし、最近の研究から、線維化したAβよりもオリゴマーというAβの集合体が神経細胞、特にシナプスを障害する作用を持っており、それが引金となり、病態が進展して、記憶障害などの認知機能障害が発症すると考えられています。現在、アルツハイマー病の治療には、神経伝達の調節に関わる薬物が対症療法的に使われていますが、まだ病態に基づいた治療法は実用化していません。研究グループがこれまでに行った研究で、Aβオリゴマーを取り除くことで、障害を受け始めた神経細胞も回復することが示唆されました(文献1、NCNP研究トピックス2017年1月)。そこで、Aβ蓄積の抑制だけでなく、Aβオリゴマーの神経毒性そのものを低減することが病気の治療につながりうるという考えの下、そのような物質を天然物、特に植物エキスおよびその成分から探索することとしました。
研究の内容
研究グループはまず、独自に確立した神経細胞モデル(文献1、2)を用いた実験で、Aβオリゴマーの神経毒性を低減する天然物を探索しました。神経毒性の指標として、まず、アポトーシス誘導のマーカーである活性化カスパーゼ3を用いました。複数の植物エキス((株)常磐植物化学研究所から提供)をAβ42オリゴマーと同時添加し、検討したところ、紅景天エキスに神経毒性抑制効果が認められました。次いで、同エキス中の複数の含有成分について同様の実験系で検討を行い、チロソールに有意な毒性低減効果を見出しました(図1)。さらに、別の実験から、チロソールはAβ42の凝集には影響せず、凝集阻害による効果ではないと考えられました。また、Aβオリゴマーとチロソールを添加した細胞では、オリゴマーのみを添加した細胞に比べて、細胞障害の指標である酸化ストレス反応に関しても抑制効果が認められました。
次に、この物質が生体においても病態を修飾する効果があるか調べるため、マウスモデルへの慢性投与実験を行いました。マウスとしては、早期に発症するトランスジェニックマウスである5XFADマウスと、対照として野生型マウスを用いました。それぞれを2群に分け、一方には水のみを、他方にはチロソールを含む水を4ヶ月令から12週間または2ヶ月令から20週間投与しました。(チロソール投与量は約12.5 mg/kg/日)(2ヶ月令はAβ蓄積開始前、4ヶ月令はAβ蓄積開始後の年齢)(図2A)。これら4群のマウス間で、体重や血清検査に異常を認めなかったことから、チロソールの安全性が確認されました。
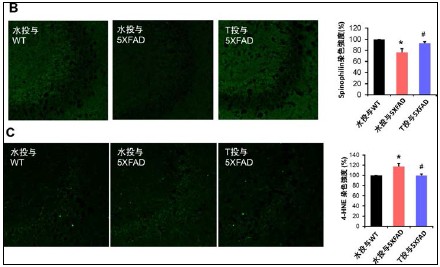
はじめに、Aβ沈着、蓄積量を調べたところ、12週投与、20週投与のどちらの場合も、大脳皮質、海馬内のAβ斑の面積、大脳皮質内に蓄積したAβ40、Aβ42の量は、水のみ投与、チロソール投与したモデルマウスで有意な差がありませんでした。次に、Aβオリゴマーは、酸化ストレス、シナプス障害を起こすこと、モデルマウスでは同様な異常が見出されることを考慮し、チロソール投与がこれらの異常に対して改善効果を持つか調べました。その結果、12週、20週投与の両方において、(1)水投与モデルマウスでは、海馬(CA1, CA3, 歯状回)においてシナプス異常(シナプス特異的タンパクのスピノフィリンの染色性の低下)がみられましたが、チロソール投与モデルマウスでは、野生型マウスと同程度まで回復していました(図2B)。(2)水投与モデルマウスでは、海馬(CA3)において、酸化ストレスのマーカーである4-ハイドロキシノネナール(4-Hydroxynonenal;4-HNE)の染色性の上昇がみられましたが、水投与モデルマウスではその上昇が抑制されました(図2C)。すなわち、チロソールの投与により、モデルマウスの酸化ストレス病態、シナプス異常が改善したことが示唆されました。さらに、空間認知機能を評価するため、バーンズ迷路試験を行った結果、12週、20週投与いずれの場合も、水投与モデルマウスでみられる空間認知機能の異常が、チロソール投与マウスでは軽度改善していました(図3)。
以上から、チロソールはAβオリゴマーの神経毒性の低減を介して、アルツハイマー病態を有意に改善し、認知障害を回復させる効果を持つことが明らかとなりました。チロソールがオリゴマーの神経毒性を低下させるメカニズムはまだ明らかではありませんが、オリゴマーが酸化ストレスを誘起することが毒性に関与しており、チロソールが抗酸化能を有することが毒性の緩和に働いている可能性があります。従って、チロソールは安全性の高いアルツハイマー病の治療・予防薬候補物質となると考えられます。
今後の展望
昨今では、アルツハイマー病の根本治療を目指した治療法開発が活発に進められています。たとえば、Aβの除去の促進や、Aβの産生を抑える治療薬として、Aβ抗体療法や、Aβ産生酵素BACE1の阻害薬などがあげられます。しかし、これらの薬剤の臨床治験では、効果が確認されたものはなく、他の治療戦略が模索されているのが現状です。今回の研究から、チロソールは病態の要の因子であるAβオリゴマーの毒性を低減することにより、アルツハイマー病態の進行を抑え、認知機能障害の悪化を防止する効果を持つ可能性が示唆されました(図4)。アルツハイマー型認知症では、発病に至る10年以上前から、脳内では徐々にAβが溜まり始めるといわれており、軽度認知障害(MCI)という認知症の予備状態でもAβがすでに蓄積していることが分かっています。このため、できるだけ早い段階で、治療を始めることの重要性が高まっています。今回のモデルマウスの実験結果から、Aβが蓄積している状態においても、チロソールが治療効果、あるいは発症予防効果をもたらす可能性があるといえます。
この物質の特徴として、チロソールはオリーブなどの植物にも含まれている天然由来の抗酸化物質であり、安全性が高いこと、経口的な投与が可能、作用機序の異なる他の薬剤と併用が可能、製剤化が容易などの実用性、低分子量(分子量=138)で脳内移行が可能などの優れた特性を持つことがあげられます。また、このチロソールの代謝物である硫化チロソールもチロソールと同程度の抗酸化作用を有するとの報告があり、脳内でも作用が持続する可能性があります。
チロソールは、新しい作用機序を介してアルツハイマー病の病態を修飾する治療および予防薬の有望な候補物質となりうることが期待されます。今後、その臨床的有効性について、治験などを通じた検証が必要と考えられます。
図1 培養神経細胞を用いたAβオリゴマー毒性低減作用を持つ物質の同定
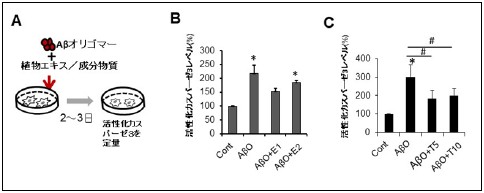
A.Aβ42オリゴマーを培養神経細胞に添加する実験において、2-3日間培養すると、アポトーシス(細胞死)の誘導が起こり、活性化カスパーゼ3のレベルが増加する。
B.Aβオリゴマーと植物エキスを同時添加する実験から、紅景天エキス(E1)に抑制効果が認められた。(E2はイチョウ葉エキス)(濃度は10 µg/ml)
C.紅景天の主要な含有成分の検討から、チロソールに有意なカスパーゼ3活性化の抑制効果が認められた。(T5: 5 µM, T10: 10 µM)
図2 アルツハイマーモデルマウス(5XFAD)のシナプス・酸化ストレス障害に対するチロソールの効果
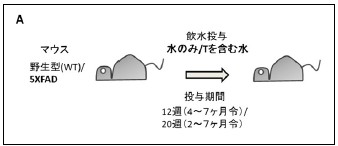
A.5XFADマウスと、対照の野生型(WT)マウスを2群にわけ、一方には水のみを、他方にはチロソール(T)を含む水を4ヶ月令から12週間または2ヶ月令から20週間投与した。
B.チロソールを20週間投与した5XFADマウスでは、海馬(CA3)におけるシナプス特異的タンパク質スピノフィリンの染色性低下の抑制がみられ、CA1、歯状回でもほぼ同様であった。(シナプス障害の抑制)
C.チロソールを20週間投与した5XFADマウスでは、海馬(CA3)における4-HNEの染色性上昇が抑制された。(酸化ストレスの抑制)
図3 アルツハイマーモデルマウスの認知機能異常に対するチロソールの効果
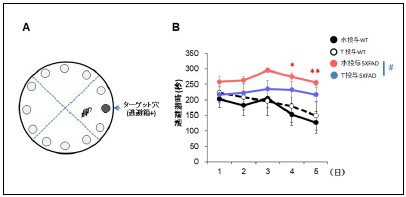
A.バーンズ迷路の模式図。マウスが12個中1個の逃避箱付きの穴に入るまでの潜時を5日間計測した。
B.水のみを20週間投与した5XFADマウスでは、野生型(WT)マウスよりも潜時が有意に延長していた(*対応のない2-way ANOVA解析)。水のみを20週間投与した5XFADマウスに比べて、チロソール投与5XFADマウスでは、薬物処置により、潜時の延長が有意に抑制されていていた(♯対応のある2-way ANOVA解析)。
図4 チロソールと他の薬剤の作用機序の違い
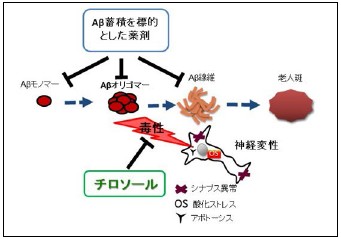
チロソールはAβオリゴマーを標的としており、その神経毒性低減を介して、アルツハイマー病態の進行を防止する効果が期待される。一方、現在開発中の薬剤の多くは、Aβ蓄積などを標的とした作用機序の異なるものであるため、チロソールは他剤との併用が可能な治療薬候補物質である。
用語解説
アミロイドベータタンパク質(Aβ)
アルツハイマー病の脳の異常構造物(老人斑)に沈着している40~43アミノ酸からなるペプチドで、同疾患の病態において中心的な役割を持つと考えられている。
Aβオリゴマー
Aβが2~30個程度集合した重合体で、神経細胞に対して毒性を持つことが知られている。アルツハイマー病の病態を引き起こす病原的因子と考えられている。
カスパーゼ3
アポトーシス(プログラム細胞死)の誘導に関与するタンパク分解酵素の一種。アポトーシスの進行において、他のカスパーゼにより切断を受け、活性型に変化し、細胞内の標的タンパク質を分解する役割を持つ。
酸化ストレス
過剰な活性酸素種が産生されて、細胞傷害が引き起こされる状態をいう。アルツハイマー病の病態にも酸化ストレスが密接に関与していることが判明している。
5XFADマウス
家族性アルツハイマー病にみられる変異を持つアミロイド前駆体タンパク質とプレセニリン1の二つの遺伝子を過剰発現するトランスジェニックマウス。病態の発現が早く、Aβが脳に約3ヶ月令から沈着し、認知機能障害が約6ヶ月令から現れる。
スピノフィリン(Spinophilin)
神経細胞の樹状突起のシナプスに特異的に発現している足場タンパク質の一種。アルツハイマー病の患者やアルツハイマーモデルマウスの脳で発現が低下しているとの報告がある。
4-ハイドロキシノネナール(4-HNE)
脂質の酸化によって生成するアルデヒドの一種で、タンパク質などに結合し、酸化障害を引き起こす。酸化ストレスのマーカーとしても用いられる。
原論文情報
- 論文名:Tyrosol reduces Aβ oligomer neurotoxicity and alleviates synaptic, oxidative, and cognitive disturbances in Alzheimer’s model mice
- 著者:谷口香織、 山本 詞子、荒井卓也、楊 金偉*、酒井祐介*、伊藤雅之、儘田 直美**、関口正幸、山田大輔***、斎藤顕宜***、亀谷富由樹****、玉岡 晃**、荒木由美子、和田圭司、水澤英洋、荒木 亘
- 所属:
- *(株)常磐植物化学研究所
- **筑波大学医学医療系神経内科学
- ***東京理科大学薬学部薬学科
- ****東京都医学総合研究所
- 掲載誌:Journal of Alzheimer’s Disease
- DOI:10.3233/JAD-190098
- https://content.iospress.com/articles/journal-of-alzheimers-disease/jad190098
参考文献
- Tanokashira D et al. Mol Brain 10:4, 2017
- Mamada N et al. Mol Brain 8: 73, 2015
助成金
本研究成果は、主に以下の助成金によって行われました。
- 国立精神・ 神経医療研究センター精神・神経疾患研究開発費(27-9, 30-3)
- 科学研究費補助金 基盤(C)「アルツハイマー病態におけるBACE1発現異常及びシナプス変性の分子機序」
お問い合わせ先
【研究に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター
神経研究所 客員研究員 荒木 亘(あらき わたる)
TEL: 042-341-2711(代表)
E-mail:![]()
【報道に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター 総務課 広報係
〒187-8551 東京都小平市小川東町4-1-1
TEL: 042-341-2711(代表) FAX: 042-344-6745



