2019年10月1日
国立研究開発法人 国立精神・神経医療研究センター(NCNP)
国立研究開発法人 日本医療研究開発機構(AMED)
国立研究開発法人 国立精神・神経医療研究センター(NCNP、東京都小平市 理事長:水澤英洋)神経研究所(所長:和田圭司)免疫研究部の研究チーム(山村 隆 部長、大木伸司室長、張 晨阳 研究員ら)は、多発性硬化症の動物モデルを用いて、脳の慢性炎症において乳汁分泌刺激ホルモンであるプロラクチンが重要な役割を果たすことを明らかにしました。プロラクチンは一般的には脳下垂体で分泌されるホルモンとして知られますが、研究チームは脳に侵入した免疫細胞(B細胞や樹状細胞)がプロラクチンを大量に産生するように変化し、このホルモンによって炎症に関係するリンパ球 (エオメス陽性ヘルパーT細胞)が誘導されて、脳の慢性炎症が悪化することを明らかにしました。プロラクチンの分泌を抑制する薬によって脳の慢性炎症に対する効果も確認できたので、神経系の慢性炎症疾患(二次進行型多発性硬化症など)の予防・治療法の開発につながることが期待されます。
この研究成果は、日本時間2019年10月1日(火)午前4時(報道解禁日時:米国東部標準時(夏時間)9月30日午後3時)米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America)オンライン版に掲載されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
- AMED委託費;難治性疾患実用化研究事業「二次進行型多発性硬化症の画期的な新規治療の開発に関する研究」 2015年度〜2017年度
- AMED委託費;難治性疾患実用化研究事業「多発性硬化症における革新的な医薬品等の開発を促進させる研究」 2015年度〜2017年度
- 国立精神・ 神経医療研究センター精神・神経疾患研究開発費「神経変性の病態解明に基づく神経保護的疾患治療法開発研究」 2018年度〜2020年度
- 日本学術振興会科学研究費補助金基盤研究A「免疫性神経疾患を修飾する新たな内分泌性制御因子と環境因子のクロストーク」2018年度〜2022年度
研究の内容
運動機能や認知機能が損なわれる脳・脊髄の病気(多発性硬化症(multiple sclerosis; MS)1)やアルツハイマー病)では、慢性的な炎症が神経細胞にダメージを与えて病気の進行に関与することが認知されるようになってきました。しかしながら、脳内で起こる慢性炎症の仕組みは充分に理解されているとは言えず、治療薬の開発も思うように進んでいません。研究チームは実験的自己免疫性脳脊髄炎(Experimental autoimmune encephalomyelitis; EAE)2)を用いて、脳内の炎症が慢性化して治りにくくなる機序について研究を進めてきました。EAEは脳の炎症性疾患であるMSの動物モデルであり、さまざまな治療薬の開発に利用されてきました。EAEを発症したマウスでは、脳や脊髄に炎症が起こり四肢の動きが悪くなります。
EAE発症の早期ではTh17細胞というインターロイキン17を産生するリンパ球が脳の炎症を誘導しますが、その時期が終わると、“エオメス陽性ヘルパーT細胞3)”というリンパ球が神経細胞にダメージを与えて脳の炎症を慢性化させます(図1)。“エオメス陽性ヘルパーT細胞”は、MSにおいても病態の慢性化に関わることがわかっていますが、“エオメス陽性ヘルパーT細胞”がどのような機序で生成するのか謎でした。今回、新しい治療法の開発につながる可能性があるため、研究チームはこの機序の解明に挑戦しました。
まず、EAEのさまざまな時期(発症早期、発症中期、発症後期)にマウスの脳から免疫細胞を分離し、その性質を解明する研究を進めました。EAEを発症すると多くのリンパ球・免疫細胞が脳内に侵入しますが、それらのなかで抗原提示機能(T細胞に抗原ペプチドを提示する機能)を持っているB細胞や樹状細胞は、乳汁分泌刺激ホルモンであるプロラクチン4)を大量に産生するように変化することがわかりました。さらにB細胞や樹状細胞は、脳内に侵入したT細胞を“エオメス陽性ヘルパーT細胞”に変化させることや、その際にプロラクチンの作用が必須であることが確認されました。また、プロラクチンの分泌を抑制する薬剤は脳内における“エオメス陽性ヘルパーT細胞”の生成を抑制して、EAEの慢性化を抑制することが証明されました(図2)。
研究の意義と今後の展開
プロラクチンは脳下垂体で産生される乳汁分泌刺激ホルモンとして知られていますが、炎症や免疫疾患における役割については、これまできわめて限られた情報しかありませんでした。今回の研究は、脳に侵入した抗原提示細胞(B細胞や樹状細胞)がプロラクチンを産生するという予想外の発見から発展し、プロラクチンがEAEにおける脳内慢性炎症に関与することを明らかにしたものです。プロラクチンはこれまで免疫・炎症疾患の領域で研究されたことは少なく、今後さらに研究が発展するものと想像されます。本研究ではプロラクチン分泌抑制剤による脳内慢性炎症に対する抑制効果も示しましたが、そのなかには現在、臨床で他疾患の治療薬として承認されている薬剤もあります。現在良い治療法のない中枢神経系の難治性疾患(二次進行型MSやアルツハイマー病など)に対する薬効も期待され、近い将来、本格的な臨床研究や臨床試験を実施する必要があると考えています。
図1 脳内慢性炎症に関与するエオメス陽性ヘルパーT細胞による神経障害
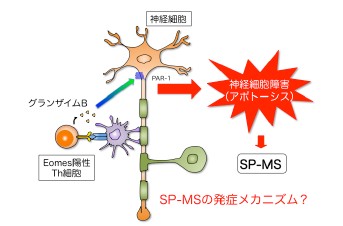
エオメス陽性ヘルパーT細胞(図中ではEomes陽性Th細胞)が脳内で産生するグランザイムBは、神経細胞の発現する受容体(PAR-1)を活性化し、これが神経細胞障害(アポトーシス)の引き金となる。EAEモデルだけではなく、二次進行型MS(図中ではSP-MS)の慢性炎症においても重要な役割を果たす。
図2 B細胞のプロラクチン産生とエオメス陽性ヘルパーT細胞の生成
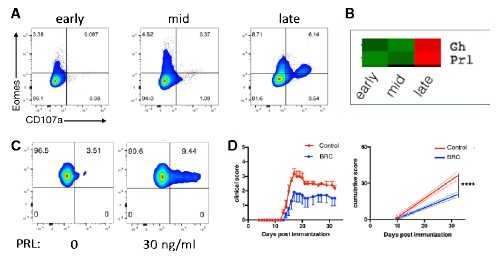
(A) EAEの発症後期(late)の脳からB細胞を分離し、試験管内でT細胞と培養した。その結果T細胞は、それまで発現していなかったエオメス(Eomes)と細胞障害活性のマーカーであるCD107aを発現するようになった。B細胞でなく樹状細胞を用いた場合にも、同様の結果が得られた。しかしEAE発症早期(early)のB細胞では、このような結果は得られなかった。midはEAEの発症中期のB細胞を用いた結果。
(B) EAEの発症早期(early)、中期(mid)、後期(late)に、脳内B細胞を分離して、それぞれの違いを検討した。マイクロアレイ解析の結果から、EAE発症後期のB細胞ではプロラクチン(Prl)と成長因子(Gh)の発現が著明に亢進していることがわかった(発現の低⇒高は、緑⇒赤で示される)。なおGhにはエオメス陽性ヘルパーT細胞を誘導する活性はなく、今回の研究対象はプロラクチンに絞った。
(C) 試験管内でプロラクチン(PRL)をT細胞に作用させたところ、エオメスの発現が誘導できた。実験Aでみられたような持続的な効果はみられなかったが、プロラクチンのエオメス誘導作用は、この実験で確認できた。
(D) プロラクチン分泌抑制薬のブロモクリプチン(BRC)を投与すると、EAE病態(縦軸)が改善した。なおブロモクリプチンは不妊治療やパーキンソン病の治療に処方される薬剤である(Zhang et al. プレスリリース該当論文より改変)。
用語解説
注1)多発性硬化症(multiple sclerosis; MS)
脳や脊髄のさまざまな部位に散在する病巣のために、視力障害や手足の麻痺、感覚障害、高次機能障害などが現れる神経難病。中枢神経系の神経軸索を覆うミエリンに対する自己免疫反応によって引き起こされる。症状の増悪と軽快を繰り返す再発寛解型MS 、症状が徐々に悪化する二次進行型MSなどに分類される。二次進行型MS では慢性炎症によって脳が徐々に障害を受け、歩行障害や認知機能が進行する。二次進行型MS では“エオメス陽性ヘルパーT細胞”が介在する慢性炎症が重視されている。
注2)実験的自己免疫性脳脊髄炎(experimental autoimmune encephalomyelitis; EAE)
MSの動物モデルで、マウスに特定のミエリン構成ペプチド(MOG35-55など)をアジュバントともに接種することによって誘導できる。ペプチドを接種してから約2週間後に、尾の麻痺、尿失禁、四肢麻痺などの症状が現れ、症状は長期間持続する。炎症の早期にはTh17細胞、後期には主に“エオメス陽性ヘルパーT細胞”が関与する。
注3)エオメス陽性ヘルパーT細胞
EAE慢性期および二次進行型MS の病態形成に関わるリンパ球である。ヘルパーT細胞の特徴を示すにもかかわらず、細胞障害性T細胞のマーカーであるエオメスを発現する。このリンパ球は細胞障害性タンパク質であるグランザイムBを放出して神経細胞死を引き起こす。
注4)プロラクチン
主に下垂体前葉のプロラクチン産生細胞が分泌し、乳中分泌、妊娠維持やこれに伴う母性行動を制御する作用がある。下垂体以外では、胎盤、子宮、活性化した免疫細胞などからも産生される。しかし免疫細胞から産生されるプロラクチンの作用や、免疫系や免疫疾患におけるプロラクチンの役割はほとんどわかっていない。
原論文情報
- 論文名:“Extrapituitary prolactin promotes generation of Eomes-positive helper T cells mediating neuroinflammation”
- 著者名:Chenyang Zhang, Ben Raveney, Hirohiko Hohjoh, Chiharu Tomi, Shinji Oki, Takashi Yamamura
- 論文名(日本語):下垂体外由来プロラクチンはエオメス陽性ヘルパーT細胞依存性の神経炎症の生成を誘導する
- 著者名(日本語): 張 晨阳、ベン・レイバニー、北條浩彦、任海千春、大木伸司、山村 隆
- 掲 載 誌: 米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America)オンライン版
- URL: https://www.pnas.org/cgi/doi/10.1073/pnas.1906438116
お問い合わせ先
【研究に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター
神経研究所 免疫研究部
大木伸司(室長)、 山村 隆(特任部長)
TEL:042-341-2711(代表)FAX:042-346-1753
e-mail:![]() ,
,![]()
【報道に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター 総務課 広報係
〒187-8551 東京都小平市小川東町4-1-1
TEL: 042-341-2711(代表) FAX: 042-344-6745
【AMED事業に関するお問い合わせ】
国立研究開発法人 日本医療研究開発機構 戦略推進部 難病研究課
〒100-0004 東京都千代田区大手町1-7-1
TEL: 03-6870-2223
E-mail:![]()



