2018年6月25日
国立研究開発法人 国立精神・神経医療研究センター(NCNP)
Tel:042-341-2711(広報係)
国立研究開発法人 日本医療研究開発機構(AMED)
Tel:03-6870-2245(企画・広報グループ
国立研究開発法人 国立精神・神経医療研究センター(NCNP、東京都小平市、理事長:水澤英洋)神経研究所(所長:和田圭司)神経薬理研究部の北條浩彦 室長らの研究グループは、難治性神経変性疾患であるハンチントン病に対してその脳内で顕著に減少しているマイクロRNAと呼ばれる機能性RNAを補充することで病態が改善することを、ハンチントン病モデル動物を用いて実証しました。特に顕著な減少を示したmiR-132と呼ばれるマイクロRNAに注目し、miR-132を脳内に補充することで、補充治療を受けたモデル動物の運動機能が改善することを見出しました。さらに、miR-132の補充を受けたモデル動物は延命することも確認されました。
根本的な治療法が確立していないハンチントン病に対して、miR-132の補充療法という新しい治療アプローチの道が拓かれたと期待されます。
本研究成果は、2018年6月1日にMolecular Therapy Nucleic Acidsオンライン版に掲載されました。
研究の背景
ハンチントン病(Huntington’s disease: HD)は、不随意運動、行動異常、認知障害、精神障害などの症状が現れる常染色体優性の遺伝性神経変性疾患です。現在のところHDに対する根本的な治療法は確立されていません。HDの原因は4番染色体にあるHuntingtin (HTT)遺伝子の変異にあります。HD患者のHTT遺伝子には、正常と比べて異常に長く伸びたCAG繰り返し配列が存在します。CAGはアミノ酸のグルタミンをコードする配列でもあり、異常伸長したCAG繰り返し配列は、異常に長く伸びたグルタミン鎖を持った変異型のHTTタンパク質を生じさせます。その変異型HTTタンパク質は、細胞内で凝集し蓄積して脳内で重要な働きをするタンパク質やメッセンジャーRNA(mRNA)の発現に影響します。それがHDの発症・病態に関わっていると考えられています。変異型HTTによって発現変化を受けるRNAの中には、遺伝子の発現をコントロールするマイクロRNA(miRNA)と呼ばれる機能性RNAも含まれます。miRNAはタンパク質をコードしない短いRNA分子ですが、タンパク質をコードしたメッセンジャーRNAの翻訳抑制を介して遺伝子の発現をコントロールする重要な働きを担っています。このような機能性RNAの発現変化は、HDの発症や病態に大きく関わっていると考えられます。今回、私達はHDと関連するmiRNAに焦点を当て、miRNAの機能不全とHDの病態との関連を明らかにするため研究を行いました。
研究の内容
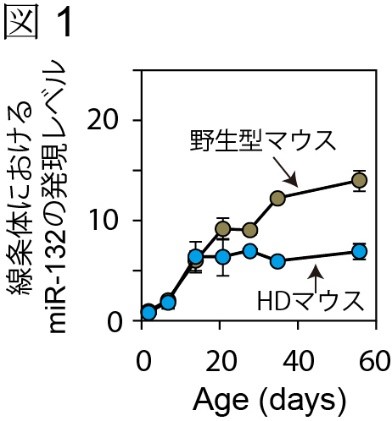
本研究は、HDの代表的なモデル動物であるR6/2マウス(HDマウスと記す)を用いて解析を行いました。まず、10週齢のHDマウスと野生型マウスの線条体(HDの障害が顕著に現れる脳部位)で発現するmiRNAを網羅的に調べました。その結果、多くのmiRNAの発現がHDマウスの脳内で減少していることが分かりました。私達は、その中で特に顕著な減少を示したmiR-132に注目しました。miR-132は、既存の報告からも、神経細胞の分化・成熟そして機能に関与するmiRNAであることが知られていました。
発現をさらに詳細に調べるために、高感度なリアルタイムPCR法を用いて生後2日目から8週齢までの線条体で発現するmiR-132を解析しました。その結果、生後2週目まではHDマウス・野生型マウス共に同じような発現上昇を示しますが、その後、野生型マウスの発現が上昇するのに対してHDマウスの発現は頭打ちになることが分かりました(図1)。これらの結果と神経細胞におけるmiR-132の密接な関係から、私達は「miR-132の不足がHDの発病や病態に関わっている」という仮説を立てました。そして、それに基づいて「不足したmiR-132を補うことでHDの病態が改善するかもしれない」という作業仮説を立て、以下の実験を行いました。
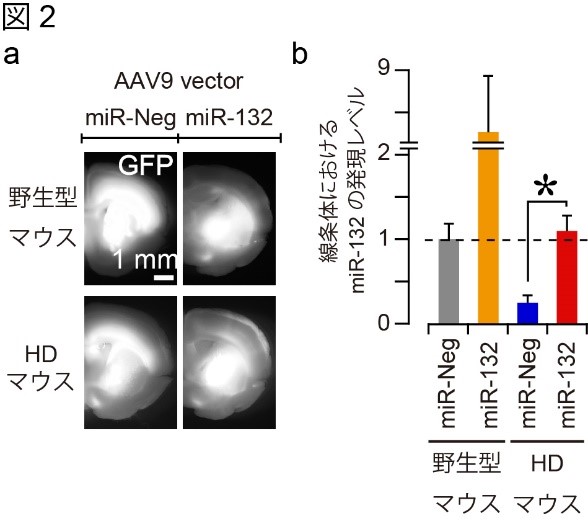
HDマウスの脳内で不足しているmiR-132を補充するために、アデノ随伴ウイルス(AAV)を用いてmiR-132を安定に発現させるmiRNA発現AAV(AAV_miR-132)を構築しました。そして、そのAAVをmiR-132の発現が頭打ちになる3週齢のHDマウスの線条体に導入しました(図2-a:構築したAAVはGFP蛍光タンパク質も発現するように設計されているため、導入したAAVを確認することができます)。4週間後、AAVを導入したHDマウスのmiR-132レベルを解析しました。その結果、野生型マウスとほぼ同じレベルまでmiR-132の発現が回復していることを確認しました(図2-b;miR-132: miR-132発現AAV;miR-Neg: コントロールの不活性型miRNA発現AAV)。
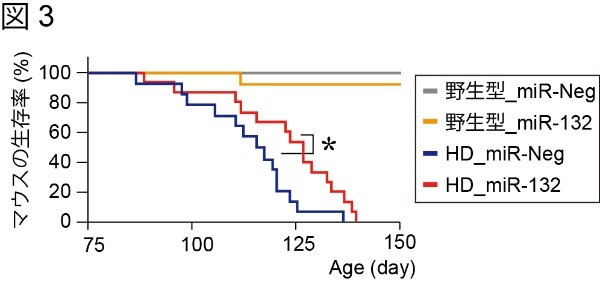
次に、miR-132が回復したHDマウスについて運動機能(ロータロッドとオープンフィールドテスト)と寿命を調べました。図3その結果、miR-132の補充による明らかな運動機能の改善と有意な延命効果を確認しました(図3)。これらの結果から導かれる可能性は「miR-132の補充(回復)によって病気の原因である異常型HTTの発現が低下した」という可能性です。そこで、その可能性を調べるためにmiR-132を回復したHDマウスの脳を調査しました。その結果、驚くべきことに、miR-132が回復しても変異型HTTの発現にはほとんど変化がないことが分かりました。以上の結果から、miR-132の補充(回復)は、疾患原因遺伝子やその遺伝子産物には影響しない別の作用機序によって症状の改善をもたらしていると考えられます。
研究の意義と今後の展開
今回の研究は、HD脳内で減少するmiR-132を補充することでHDの病態が改善することを証明しました。そして、病気の原因となる疾患原因遺伝子やその遺伝子産物にはほとんど影響しないという観察結果は、疾患原因遺伝子やその遺伝子産物を直接ターゲットにした従来の治療戦略とは異なる、別の作用機序に基づく病態の改善であることを示唆しています。よって、本研究の成果は、難治性の神経変性疾患に対して従来の治療アプローチとは異なる別のアプローチによる新しい治療の道を拓いたといえます。さらに、miR-132の減少はHD患者やHDマウスだけでなく、アルツハイマー病や統合失調症の患者でも観察されています。miR-132が減少するこれらの疾患に対しても、miR-132の補充が有効な治療(緩和)法になる可能性が考えられます。したがって、miR-132の補充は疾患原因遺伝子に制限されない汎用性の高い治療を提供するかもしれません。
最後に、miR-132の脳内減少は神経変性や神経機能不全と深く関わっていると考えられます。これらの関連は今後の研究課題であり、miR-132補充による改善の作用機序と合わせて明らかにしていきたいと考えています。
用語の説明
ハンチントン病
常染色体優性遺伝子形式を示す難治性の神経変性疾患。舞踏運動などの不随意行動、行動異常、認知障害、精神障害といった症状が現れる。わが国の有病率は人口10万人あたり0.7人と推定されている(http://www.nanbyou.or.jp/entry/175)。疾患原因は4番染色体にあるHuntingtin(HTT)遺伝子の変異であり、患者のHTT遺伝子第一エクソン内にあるCAG繰り返し配列が正常よりも異常伸長しているため、異常伸長型ポリグルタミン鎖を持った変異型HTTタンパク質が発現する。変異型HTTタンパク質は細胞内で凝集・蓄積し、ハンチントン病の発症・病態に関わっている。
R6/2マウス(ハンチントン病モデルマウス)
ヒト変異型HTT遺伝子の第一エクソン部分を発現するトランスジェニックマウス。ハンチントン病様の症状を早期から呈するマウスであり、ハンチントン病研究に広く用いられている。
マイクロRNA(miRNA)
21~23塩基鎖長の機能性RNA。タンパク質をコードしないRNA遺伝子であり、ヒトゲノム上には数千のmiRNA遺伝子が同定されている。miRNAはRNA-induced silencing complex (RISC)の中に取込まれて遺伝子サイレンシングのメディエーターとして働く。miRNAと完全または部分相補的な配列をもったメッセンジャーRNA(タンパク質をコードするRNA)を標的とし、その翻訳(タンパク質合成)を制御することによって遺伝子の発現を制御している。
リアルタイムPCR法
解析目的の遺伝子の量(発現量など)を知るための定量PCR法。試験管内で目的遺伝子を特異的に増幅させるPCR技術を用いて、その増幅過程を測定することで元の遺伝子の量を知ることができる方法。
原論文情報
論文名:“Supplemental treatment for Huntington’s disease with miR-132 that is deficient in Huntington’s disease brain”
著 者:Masashi Fukuoka, Masaki Takahashi, Hiromi Fujita, Tomoko Chiyo, H. Akiko Popiel, Shoko Watanabe, Hirokazu Furuya, Miho Murata, Keiji Wada, Takashi Okada, Yoshitaka Nagai, and Hirohiko Hohjoh
掲 載 誌:Molecular Therapy Nucleic Acids
DOI:https://doi.org/10.1016/j.omtn.2018.01.007
助成金
本成果は、以下の研究事業・研究課題によって得られました。
- 国立研究開発法人日本医療研究開発機構 日本医療研究開発機構 難治性疾患実用化研究事業「難治性神経変性疾患に対する神経シナプス形成を促進させるマイクロRNAの補充による新規治療法の開発と確立」
- 厚生労働省 厚生労働科学研究委託業務(難治性疾患等克服研究事業(難治性疾患等実用化研究事業(難治性疾患実用化研究事業)))「難治性神経変性疾患に対する神経シナプス形成を促進させるマイクロRNAの補充による新規治療法の開発と確立」
- 国立研究開発法人日本医療研究開発機構 日本医療研究開発機構 難治性疾患実用化研究事業「強力な筋分化誘導能を有するマイクロRNAを用いた新規筋疾患治療アプローチの開発と確立」
- 科学研究費補助金 基盤研究(B)、挑戦的萌芽研究、若手研究(B)
お問い合わせ先
【研究に関するお問い合わせ先】
北條 浩彦(ほうじょう ひろひこ)
国立研究開発法人 国立精神・神経医療研究センター 神経研究所
神経薬理研究部 室長
〒187-8502 東京都小平市小川東町 4-1-1
TEL: 042-341-2711(代表) FAX:042-346-3594
E-mail:![]()
【報道に関するお問い合わせ先】
国立研究開発法人
国立精神・神経医療研究センター
総務課 広報係
〒187-8551 東京都小平市小川東町4-1-1
Tel:042-341-2711(代表)Fax: 042-344-6745
【AMED事業に関するお問い合わせ先】
国立研究開発法人日本医療研究開発機構
戦略推進部 難病研究課
TEL:03-6870-2223
E-mail:![]()



