2019年7月2日
国立研究開発法人 国立精神・神経医療研究センター (NCNP)
帝京大学
国立研究開発法人 日本医療研究開発機構(AMED)
国立研究開発法人 国立精神・神経医療研究センター(NCNP、東京都小平市、理事長:水澤英洋)神経研究所(所長:和田圭司)疾病研究第一部の西野一三 部長、野口悟 室長、井上道雄 流動研究員と神経研究所疾病研究第二部の後藤雄一 部長、メディカル・ゲノムセンターの飯田有俊 室長、小児神経科の小牧宏文 医師、帝京大学医学部小児科の三牧正和 教授、内野俊平 研究支援員らの研究グループは、生後間もなく、あるいは幼少期から「筋力が弱い」「体が柔らかい」などの症状がある先天性ミオパチー患者さんの新たな病因としてCOX6A2遺伝子変異を発見しました。COX6A2はミトコンドリア電子伝達系のチトクロームc酸化酵素(COX)を構成するタンパク質の一つで、今回の症例では、横紋筋(骨格筋と心筋)に限定されたミトコンドリア異常を認めました。
先天性ミオパチーは生まれながらに筋組織の形状に異常がある、遺伝子変異による難病で、国内にはおよそ1,000~3,000名の患者さんがいると推定されています。しかし、現在でも病気の原因遺伝子が特定できない患者さんが7割以上を占めます。一方、COX欠損症は、難病であるミトコンドリア病(※1)の一つで、酵素欠損が見いだされる病気であり、多くの場合、多臓器が障害されます。そのミトコンドリア病は、全身の細胞の中にあってエネルギーを産生する働きをもつミトコンドリアの機能が低下して発症する病気で、比較的エネルギーを多く必要とする中枢神経、骨格筋、心臓などの臓器の症状が現れやすいと考えられています。
我々の研究グループは、臨床的に先天性ミオパチーと診断された乳幼児患者さん2名に全エクソーム解析(※2)を行い、COX6A2遺伝子に両アレル性のミスセンス変異(※3)を認めました。さらに、骨格筋ではCOX活性の低下と複合体Ⅳのアセンブリー障害(複合体を組み立てる過程で異常が起こること)もありました。つまり、COX6A2変異が原因で患者さんの症状が引き起こされると考えられました。この2名の患者さんは共通して乳児期までに骨格筋の症状があり、1人は心筋の症状がありました。そして他の臓器の症状はありませんでした。COX6A2遺伝子が骨格筋と心筋のみに発現しているため、症状が骨格筋と心筋に限定されていることが分かりました。これは、これまでのミトコンドリア病のCOX欠損症とは異なる、横紋筋特異的な症状がある新たなCOX欠損症の発見です。
今後、COX6A2遺伝子変異を持つ患者さんの診断と治療法の開発が進むことが期待され、先天性ミオパチーとミトコンドリア病の両疾患における更なる研究・臨床開発に新しい知見をもたらすものと考えます。
本研究は、NCNPと帝京大学、KU Leuven(ベルギー)、立命館大学、大阪大学との共同研究として、日本医療研究開発機構(AMED)などの支援によって行われたもので、研究成果は、日本時間2019年7月2日(火)午後6時(報道解禁日時:米国東部標準時2019年7月2日午前4時)に米国科学誌『Annals of Neurology』オンライン版に掲載されました。
研究の背景
先天性ミオパチー(※4)は先天的に骨格筋の構造に異常がある疾患であり、様々な遺伝子の変異によって引き起こされることがわかっています。しかし、7割以上の患者さんで原因遺伝子を特定できておらず、それらの患者さんの原因遺伝子を明らかにすることは大きな課題となっています。
一方、ミトコンドリアでATP(エネルギー)を生み出す呼吸鎖複合体(※5)の5つのうち1つにチトクロームc酸化酵素(COX、または複合体IVとも呼ばれます)という酵素があります。ミトコンドリアは全身に分布する細胞小器官であるため、COX欠損症では多くの場合、全身の複数の臓器が障害されます。これまでに横紋筋(骨格筋と心筋)にだけ症状を持つCOX欠損症を起こす核遺伝子の報告はありませんでした。
研究の内容
乳児期より筋力の低下や筋緊張の低下(グニャグニャと体がやわらかい)があって、臨床的に先天性ミオパチーと診断された患者さん2人に全エクソーム解析(※2)を行い、COX6A2遺伝子に両アレル性のミスセンス変異を見出しました。患者さん2人には共通して骨格筋の症状があり、1人は心筋の症状を認めましたが、他の臓器の症状はありませんでした。患者さんの骨格筋ではCOX活性が低下していましたが、これは複合体IVのアセンブリー(集合、組み立て)の障害と変異タンパク質の不安定性によるものと考えられました。ノックアウトマウス(特定の遺伝子を無効化したマウス)の骨格筋でも患者さんと同様の結果が得られました。COX6A2は、骨格筋と心臓にのみ発現しているため、症状が骨格筋・心筋に限定されたと考えられました。我々は、これまでのCOX欠損症と異なる、横紋筋(骨格筋・心筋)特異的な症状を来す新たなCOX欠損症の原因遺伝子を明らかにすることに成功しました。
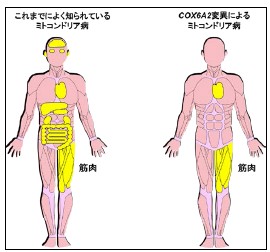
図1. 従来のミトコンドリア病とCOX6A2変異によるミトコンドリア病の比較
障害されている臓器を黄色で示しています。これまでによく知られているミトコンドリア病では、多くの場合、脳、筋肉、肝臓、腎臓などの全身の多臓器が障害されます。それに対して、COX6A2変異によるミトコンドリア病では筋肉と心臓以外の臓器は障害されていませんでした。そのため、症状からは先天性ミオパチーという別の病気の可能性が考えられやすくなり、診断が難しくなります。
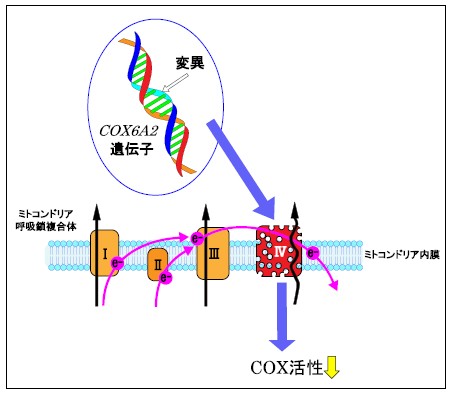
図2. COX6A2変異がCOX活性低下を起こすメカニズム
ミトコンドリアの内膜には呼吸鎖複合体があり、電子 (e-) を受け渡し(ピンク矢印)、プロトン(H+)を移動させています (黒矢印)。COX6A2遺伝子に変異が起こることによって、複合体IV(COX)のアセンブリー(集合、組み立て)に障害が起こり、複合体IVは不安定になります。その結果、COX活性が低下し、症状を起こすと考えられます。
今後の展望
本研究成果で、骨格筋・心筋のみが障害され、先天性ミオパチーと診断されている患者さんの中に、COX6A2遺伝子変異を持つ患者さんが存在する可能性があることが分かりました。今後、臨床像が一致する患者さんについては筋生検・筋病理学的な評価、COX6A2遺伝子の変異解析がなされることが期待されます。それによってCOX6A2変異を持つ患者さんの診断が多くなされるようになれば、COX6A2変異によってどんな症状が引き起こされるのかがより正確にわかっていきます。さらに、原因遺伝子を発見したことは、今後の治療法の開発における第一歩となるものです。
用語解説
※1 ミトコンドリア病
ミトコンドリア病はエネルギー代謝系の先天代謝異常症であり、7500出生に1人とされています。ミトコンドリア病は基本的にミトコンドリア呼吸鎖複合体の異常によって引き起こされ、5つの呼吸鎖複合体の中で、複合体IVの異常であるCOX欠損症は、複合体Iの異常に次いで2番目に多いとされます。最もよくみられるCOX欠損症であるLeigh脳症では脳や骨格筋、肝、腎などに症状が出ます。その他、視力低下、難聴、貧血、末梢神経障害などCOX欠損症の症状は非常に多様です。
※2 全エクソーム解析
ゲノム全体の配列のうち、タンパク質をコードするエクソン部分の配列のみを、選択的に解析する手法です。
※3 両アレル性
2本ずつある染色体の両方にある遺伝子において、という意味です。
ミスセンス変異
変異(この場合遺伝子の暗号に変化が起きること)によってアミノ酸の変化を起こす変異です。
※4 先天性ミオパチー
骨格筋そのものに構造的な異常がある筋疾患「ミオパチー」のうち、先天性に(多くは乳児期早期までに)発症するものの総称です。共通した症状の特徴として、運動発達の遅れや筋緊張低下(体がグニャグニャした感じがする)、筋力低下があります。
※5 ミトコンドリア呼吸鎖複合体
ミトコンドリアにおいてATPを産生するタンパク質複合体で5種類が知られています。その異常によってエネルギー産生が低下し、活性酸素種の産生増加により、細胞機能の低下が起こり、ヒトにおいて様々な臓器障害を伴うミトコンドリア病を引き起こします。
原論文情報
- 論文名:COX6A2 variants cause a muscle-specific cytochrome c oxidase deficiency
- 著者:Michio Inoue, Shumpei Uchino, Aritoshi Iida, Satoru Noguchi, Shinichiro Hayashi, Tsutomu Takahashi, Katsunori Fujii, Hirofumi Komaki, Eri Takeshita, Ikuya Nonaka, Yukinori Okada, Takuya Yoshizawa, Leentje Van Lommel, Frans Schuit, Yu-ichi Goto, Masakazu Mimaki, Ichizo Nishino
- 掲載誌:Ann Neurol. 2019 Jun 2. doi: 10.1002/ana.25517. [Epub ahead of print]
- DOI:10.1002/ana.25517.
- URL:https://onlinelibrary.wiley.com/doi/10.1002/ana.25517
助成金
本研究成果は、以下の補助金・事業・助成金によって行われました。
- 国立研究開発法人 日本医療研究開発機構(AMED)難治性疾患実用化研究事業「遺伝性筋疾患の統合的ゲノム解析拠点形成」(19ek0109285h0003)
- 国立精神・神経医療研究センター 精神・神経疾患研究開発費
お問い合わせ先
【研究に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター
神経研究所 疾病研究第一部室長 野口悟(のぐち さとる)
TEL: 042-346-1712 FAX: 042-346-1742
E-mail: ![]()
帝京大学 本部広報課
〒173-8605 東京都板橋区加賀2-11-1
TEL:03-3964-4162 FAX:03-3964-9189
E-mail:![]()
【報道に関するお問い合わせ】
国立研究開発法人 国立精神・神経医療研究センター 総務課 広報係
〒187-8551 東京都小平市小川東町4-1-1
TEL: 042-341-2711(代表) FAX: 042-344-6745
【AMED事業に関するお問い合わせ】
国立研究開発法人 日本医療研究開発機構 戦略推進部 難病研究課
〒100-0004 東京都千代田区大手町1-7-1
電話:03-6870-2223
E-mail:![]()



