2020年11月10日
理化学研究所
国立精神・神経医療研究センター
印刷用PDF(5.88MB)
機能低下したミトコンドリアを活性化させる化合物
-解糖系酵素ホスホフルクトキナーゼ阻害剤とその新活性の発見-
理化学研究所(理研)環境資源科学研究センター創薬・医療技術基盤連携部門創薬シード化合物探索基盤ユニットの小林大貴研究員(研究当時)、ケミカルゲノミクス研究グループの吉田稔グループディレクター、国立精神・神経医療研究センター(NCNP)神経研究所疾病研究第二部の畠山英之研究員、後藤雄一部長(メディカル・ゲノムセンター長)らの共同研究グループ※は、ミトコンドリア呼吸を活性化する物質として、解糖系[1]律速酵素の一つであるホスホフルクトキーナーゼ(PFK1)を阻害する低分子化合物「tryptolinamide(TLAM)」を発見しました。
本研究成果は、細胞内エネルギー代謝に関する基礎研究の発展はもとより、遺伝病の一種であるミトコンドリア病[2]の治療法開発やヒトの健康寿命の延伸にも貢献すると期待できます。
ミトコンドリアは、酸素呼吸を通して細胞エネルギーを生産する役割を担っており、そのゲノムであるミトコンドリアDNA(mtDNA)は、細胞の呼吸機能に不可欠なタンパク質群をコードしています。そのため、mtDNAの一部が変異することで、生物の呼吸機能に悪影響を及ぼし、ミトコンドリア病の発症と密接に関連することが知られています。
今回、共同研究グループは理研NPDepo化合物ライブラリー[3]を用いて、ミトコンドリア呼吸活性化物質を探索した結果、化合物TLAMの同定に成功しました。さらに、TLAMは解糖系律速酵素のPFK1を阻害し、細胞内代謝を変化させることで、mtDNAの変異によって低下したミトコンドリア呼吸機能を回復させることを明らかにしました。
本研究は、科学雑誌『Nature Chemical Biology』オンライン版(11月9日付:日本時間11月10日)に掲載されました。
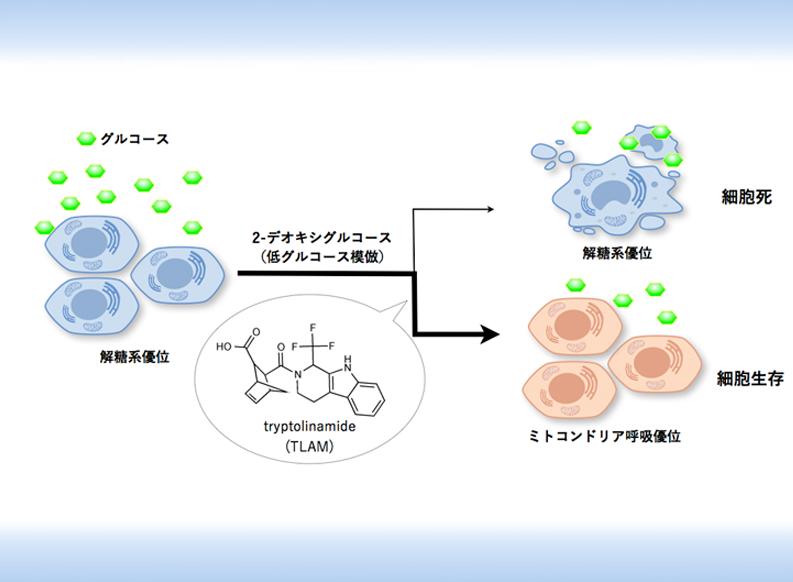
TLAM は PFK1 を阻害することで、ミトコンドリア呼吸機能を回復させる
※共同研究グループ
理化学研究所
環境資源科学研究センター
創薬・医療技術基盤連携部門 創薬シード化合物探索基盤ユニット
ユニットリーダー 吉田 稔 (よしだ みのる)
(ケミカルゲノミクス研究グループ グループディレクター、
東京大学大学院農学生命科学研究科 教授)
研究員(研究当時) 小林 大貴 (こばやし ひろき)
テクニカルスタッフⅠ 西村 はる菜(にしむら はるな)
ケミカルバイオロジー研究グループ
グループディレクター 長田 裕之 (おさだ ひろゆき)
生命機能科学研究センター タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(しろうず みかこ)
技師 苫米地 由里(とまべち ゆり)
国立精神・神経医療研究センター 神経研究所疾病研究第二部
部長 後藤 雄一 (ごとう ゆういち)
(メディカル・ゲノムセンター センター長)
研究員(研究当時) 畠山 英之 (はたけやま ひでゆき)
研究員(研究当時) 横田 睦美 (よこた むつみ)
研究員 鈴木 禎史 (すずき さだふみ)
帝京大学 医学部 小児科
教授 三牧 正和 (みまき まさかず)
研究支援
本研究は日本学術振興会(JSPS)科学研究費補助金基盤研究S「革新的化学遺伝学による内在性代謝物の新機能の解明と応用(研究代表者:吉田稔)」、文部科学省(MEXT)科学研究費補助金新学術領域研究「ユビキチン機能制御のためのケミカルバイオロジー(研究代表者:吉田稔)」、厚生労働省(MHLW)難治性疾患等政策研究事業「ミトコンドリア病の調査研究(研究代表者:後藤雄一)」、JSPS若手研究B「ワールブルグ効果制御物質の作用機序解明(研究代表者:小林大貴)」、JSPS 若手研究「解糖系代謝フロー切替によるがん悪性化形質獲得機序の解析(研究代表者:小林大貴)」の支援を受けて行われました。
1.背景
ミトコンドリア病は、ミトコンドリア呼吸機能の低下により、主に筋肉や神経などエネルギーを多量に必要とする組織で臨床症状が現れるだけでなく、解糖系へのエネルギー依存度が高くなるため、乳酸アシドーシス[4]が引き起こされます。エネルギー生産効率の高い呼吸機能を回復させることが、ミトコンドリア病の治療戦略の一つになると考えられていますが、不完全な呼吸鎖を活性化することで発生する活性酸素種(ROS)[5]が、細胞にダメージを与えることが懸念されます。現在、呼吸改善作用あるいは抗酸化作用を持つ複数の治療薬候補の有効性や安全性が、臨床試験で試されているところですが、確実な治療法はまだ確立されていません。
そこで、共同研究グループはケミカルバイオロジーの手法により、ミトコンドリア病の新たな治療標的を見いだすことを目的に研究を実施しました。
2.研究手法と成果
共同研究グループは、ミトコンドリア病で起きているエネルギー代謝変化に注目しました。ミトコンドリア病では、呼吸が低下し解糖系への依存度が高くなっています。この代謝バランスを正常に近づければ、低下したエネルギー(ATP)生産性を回復させ、かつ解糖系の最終産物であり、乳酸アシドーシスの原因となる乳酸の生産量を減少させることができるはずです。
このような代謝調節作用を持つ化合物を、ミトコンドリア病患者由来の細胞の代わりに、同様の解糖系に依存したエネルギー代謝である「ワールブルグ効果[6]」を示すがん細胞を用いて探索することにしました。がん細胞は、エネルギー合成効率が低い解糖系に依存しているため、低グルコース培地ではエネルギー不足になり、細胞死が誘導されます。一方、がん細胞のエネルギー代謝バランスをミトコンドリア呼吸優位にできれば、エネルギー合成効率が高まるため、低グルコース培地での細胞死が抑制されます。
低グルコース状態を誘起する2-デオキシグルコースによる細胞死を抑制する化合物を理研NPDepo化合物ライブラリーから探索した結果、活性化合物を見いだし、「tryptolinamide(TLAM)」と命名しました(図1)。代謝解析の結果、TLAM は、がん細胞の代謝バランスをミトコンドリア呼吸にシフトさせることが分かりました。さらに、ミトコンドリア病の一つであるMELAS[7]の患者由来の変異ミトコンドリアDNA(mtDNA)(m.3243A>G、3243番目の塩基がAからGに変異)を持つサイブリッド(細胞質融合細胞)[8]および別のMELAS患者(m.3243A>G)細胞由来のiPS細胞[9]から作製した分化細胞においても、同様にエネルギー代謝を呼吸優位にシフトさせることが分かりました。
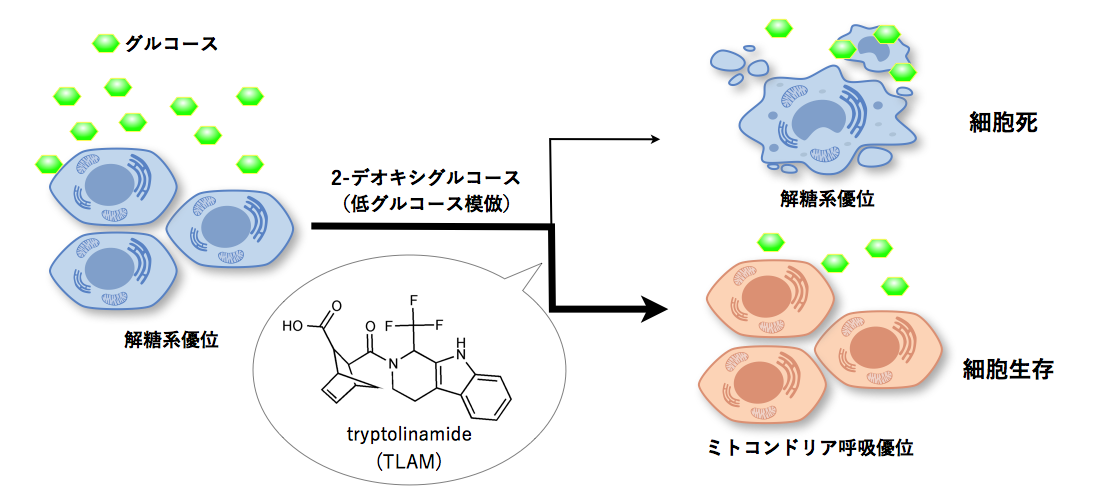
図1 Tryptolinamide (TLAM) の発見
エネルギー代謝バランスをミトコンドリア呼吸にシフトさせる化合物を探索するため、2-デオキシグルコースによって誘導されるがん細胞の細胞死を抑制する化合物を探索した。その結果、tryptolinamide(TLAM)を発見した。
次に、TLAMの作用機序解析を行いました。生化学的な解析から、TLAMはAMP活性化プロテインキナーゼ(AMPK)[10]の活性化を介した脂肪酸分解[11]により、ミトコンドリア呼吸を活性化することが示されました。また、細胞内エネルギー代謝に関わる代謝物質の網羅的定量解析(定量メタボローム解析)により、TLAMは解糖系律速酵素ホスホフルクトキナーゼ(PFK1)の活性に影響を与えていることが示唆されました。これを手掛かりとして、組換えPFK1タンパク質を用いて検討した結果、TLAMがPFK1に直接作用することで、その酵素反応を阻害することを明らかにしました。
さらに、TLAM による細胞内エネルギー代謝シフトがPFK1阻害によりもたらされるのかを調べるため、CRISPR/Cas9 技術[12]を用いてPFK1ノックアウト細胞を作製しました。その結果、PFK1ノックアウト細胞は、TLAMを与えた細胞と同様にミトコンドリア呼吸優位の代謝を示し、またTLAMを与えても代謝変化が誘導されませんでした。これにより、TLAM による細胞内エネルギー代謝シフトがPFK1阻害によりもたらされることが確かめられました。解糖系律速酵素であるPFK1を阻害することで、ミトコンドリア呼吸機能が増強する理由の一つは、 AMPKの活性化です。実際、TLAMを処理したPFK1野生型の細胞と同様に、PFK1ノックアウト細胞は、PFK1野生型の細胞に比べて高いAMPK活性を示すことが確認されました。
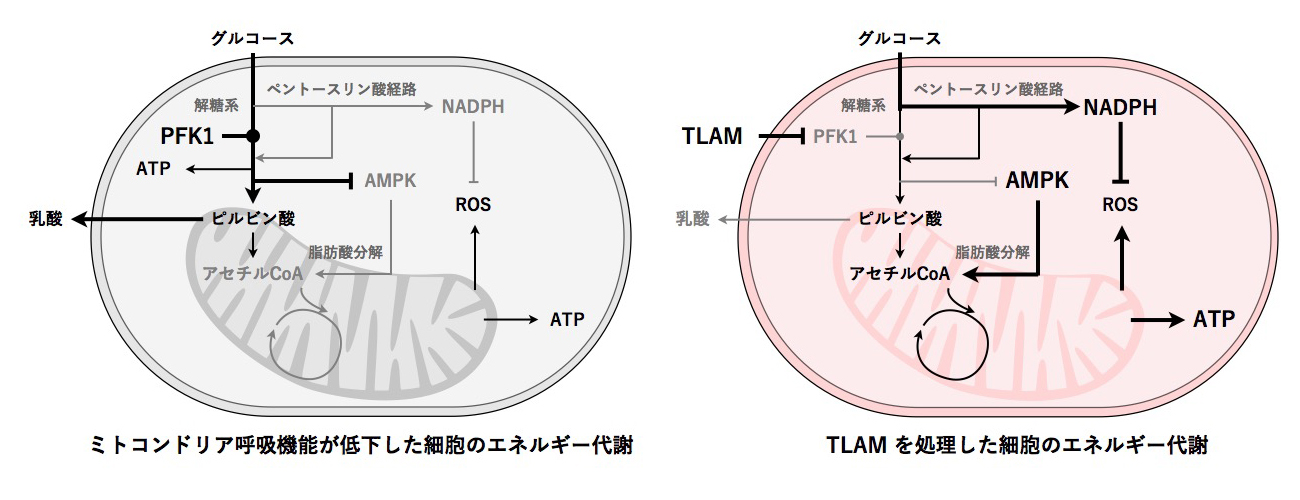
一方、PFK1 は解糖系のゲートキーパーとなっており、PFK1を阻害すると、解糖系の側方経路であるペントースリン酸経路[13]への代謝フローが迂回、増大します。ペントースリン酸経路は、酸化ストレスに対抗するために重要なNADPH(還元型ニコチンアミドジヌクレオチドリン酸)を産生する経路としても知られています。遺伝学的解析により、AMPK活性化・脂肪酸分解に加えて、ペントースリン酸経路の亢進も、TLAMによるミトコンドリア呼吸増強に必要であることが示されました(図2)。

図2 TLAM によるエネルギー代謝変換
左: ミトコンドリア呼吸機能が低下した細胞は、解糖系に依存したエネルギー代謝になっている。
右: TLAM を処理すると、PFK1 が阻害され、乳酸の産生量低下が誘導される。また、AMPK 活性化による脂肪酸分解とペントースリン酸経路の亢進が誘導され、ミトコンドリア呼吸が増強する。
最後に、TLAMがミトコンドリア病患者から樹立されたiPS細胞の病的な表現型に与える影響を評価しました。変異したmtDNAを高頻度で持つiPS細胞は、神経幹細胞までは分化できるものの、神経細胞にまでは分化できません。これはエネルギー消費の高い神経細胞では、ミトコンドリア機能障害により細胞死が起きてしまうためと考えられます。実験の結果、TLAMは、m.3243A>Gあるいはm.3291T>C(3291番目の塩基がTからCに変異)のmtDNAを高頻度に持ったiPS細胞の神経細胞(NF-H[14]陽性細胞)への分化障害を改善させることが分かりました(図3)。このことは、PFK1を阻害することで、mtDNAに起因するミトコンドリア病の病態を改善できる可能性を示しています。
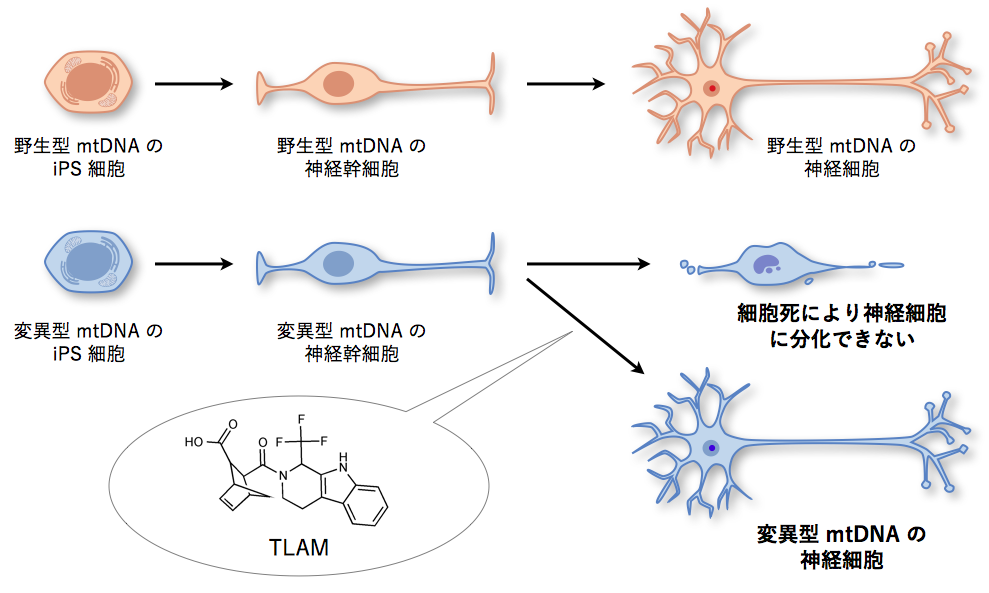
図3 TLAM による変異 mtDNA を持った iPS 細胞の神経細胞への分化障害の回復
変異型 mtDNA を高頻度に持つ iPS 細胞は、ミトコンドリア機能障害のため神経細胞には分化できないが、TLAM はこの分化障害を回復させた。
3.今後の期待
PFK1 を阻害することでエネルギー代謝がシフトし、ミトコンドリア呼吸の低下を改善できるという本研究の成果は、細胞内エネルギー代謝に関する生物学的知見として極めて重要です。また、PFK1阻害は、①ミトコンドリア呼吸だけでなくアシドーシスを改善する、②ペントースリン酸経路の亢進によるNADPH 産生が不完全な呼吸マシナリーを活性化することで発生するROSによる細胞ダメージを緩和することが期待されます。そのため、PFK1阻害はミトコンドリア病治療の観点から複数のメリットを持つ、これまでにない治療標的になり得ます。
また、ミトコンドリア機能低下は、ミトコンドリア病だけでなく、老化、がん、神経変性疾患を含むさまざまな疾患に関連しているため、本研究成果が足掛かりとなって、ヒトの健康寿命の延伸に資する新しい方法の開発につながると期待できます。
本研究は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)」のうち、「3. すべての人に健康と福祉を」に大きく貢献する成果です。
4.論文情報
<タイトル>
Chemical reversal of abnormalities in cells carrying mitochondrial DNA mutations
<著者名>
Hiroki Kobayashi, Hideyuki Hatakeyama, Haruna Nishimura, Mutsumi Yokota, Sadafumi Suzuki, Yuri Tomabechi, Mikako Shirouzu, Hiroyuki Osada, Masakazu Mimaki, Yu-ichi Goto, and Minoru Yoshida
<雑誌>
Nature Chemical Biology
<DOI>
10.1038/s41589-020-00676-4
5.補足説明
[1] 解糖系
グルコースを初発物質として、一連の酵素反応によりピルビン酸、乳酸に分解し、その分解過程でエネルギーを産生する代謝経路。
[2] ミトコンドリア病
ミトコンドリアの機能の低下が原因で起こる病気。脳卒中や精神症状、認知症、心筋症、糖尿病など種々の症状を呈する。
[3] 理研NPDepo化合物ライブラリー
天然由来化合物を基礎とした理研天然化合物バンク。
[4] 乳酸アシドーシス
血中乳酸値が上昇し、血液が酸性に傾いた状態。嘔吐、腹痛、下痢、倦怠感などの症状を呈する。
[5] 活性酸素種(ROS)
化学的に活性になった状態の酸素。呼吸に伴い発生するほか、炎症反応や化学物質の暴露により発生する。さまざまな生命現象に重要な役割を果たすが、過剰な蓄積は細胞に対して毒性を持つ。ROSはReactive Oxygen Speciesの略。
[6] ワールブルグ効果
がん細胞は、有酸素下でもミトコンドリアの酸化的リン酸化より、解糖系でATPを産生する活性が高い。この際、グルコースは解糖系で代謝された後にミトコンドリアに入ることなく、乳酸に変換され、細胞外へ分泌される。これをワールブルグ効果と呼ぶ。
[7] MELAS
ミトコンドリア病の中では頻度の高い病気であり、特徴的な脳卒中様症状のほか、合併する臓器症状が多様であることが知られる。MELAS はmitochondrial myopathy, encephalopathy, lactic acidosis, and stroke-like episodesの略。
[8] サイブリッド(細胞質融合細胞)
被験者のミトコンドリアDNA の解析を行うため、ミトコンドリアDNA を失った培養細胞(ρ0 細胞)に、脱核した被験者由来の細胞(細胞質)を融合して作製した細胞。
[9] iPS細胞
体細胞・組織から採取した細胞に Oct4, Klf4, Sox2, Myc 遺伝子などを導入することで人工的に作製された、全ての種類の体細胞へ分化できる能力を持つ多能性幹細胞。
[10] AMP活性化プロテインキナーゼ(AMPK)
細胞内エネルギー状態のセンサーとして働き、その状態に応じて糖・脂質代謝を調節するセリン・スレオニンキナーゼ。AMPK はAMP-activated protein kinaseの略。
[11] 脂肪酸分解
ミトコンドリア内で脂肪酸を分解し、アセチル CoA、FADH2、NADH などのミトコンドリア呼吸の基質を産生する経路。
[12] CRISPR/Cas9技術
ゲノム編集技術の一つで、標的ゲノム領域を認識する配列とCas9と複合体を形成する配列からなるgRNA(ガイドRNA)およびヌクレアーゼ活性により、DNAを切断するCas9タンパク質からなる。これらを細胞に導入すると、複合体を形成して標的ゲノムを切断する。細胞がこれを修復する際、ゲノムに欠失や挿入が起きて遺伝子をノックアウトできる。
[13] ペントースリン酸経路
核酸合成に必要なリボースや脂質合成、酸化ストレス抑制に重要な NADPHを合成する経路。
[14] NF-H
神経細胞の細胞骨格を構成するタンパク質の一つ。 NF-H はNeurofilament heavy polypeptide の略。
6.発表者・機関窓口
<発表者> ※研究内容については発表者にお問い合わせください。
理化学研究所
創薬・医療技術基盤連携部門 創薬シード化合物探索基盤ユニット
研究員(研究当時) 小林 大貴 (こばやし ひろき)
ユニットリーダー 吉田 稔 (よしだ みのる)
(ケミカルゲノミクス研究グループ グループディレクター、
東京大学大学院農学生命科学研究科 教授)
TEL: 048-467-9516(吉田) FAX:048-462-4676
E-mail:kobayashihiroki[at]riken.jp(小林)、yoshidam[at]riken.jp(吉田)

小林 大貴

吉田 稔
国立精神・神経医療研究センター
神経研究所疾病研究第二部
研究員 畠山 英之 (はたけやま ひでゆき)
部長 後藤 雄一 (ごとう ゆういち)
(メディカル・ゲノムセンター センター長)
TEL:042-346-3524(後藤) FAX:042-346-3559(後藤)
E-mail:goto[at]ncnp.go.jp (後藤)

畠山 英之

後藤 雄一
<機関窓口>
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
理化学研究所 広報室 報道担当
E-mail:ex-press[at]riken.jp
国立精神・神経医療研究センター 総務課広報係
TEL:042-341-2711(代表) FAX:042-344-6745
E-mail: ncnp-kouhou[at]ncnp.go.jp
※上記の[at]は@に置き換えてください。