2021年1月15日
国立研究開発法人国立精神・神経医療研究センター(NCNP)
印刷用PDF(954KB)
脳のなかのシナプスを作る新しいメカニズムを発見
〜蛋白質の情報をコードしないRNAがシナプス形成を調節する
-神経発達障害との関連性も〜
〜蛋白質の情報をコードしないRNAがシナプス形成を調節する
-神経発達障害との関連性も〜
国立精神・神経医療研究センター(NCNP)神経研究所疾病研究第五部室長:若月修二、部長:荒木敏之らの研究グループ※は、非コードRNA(*1)が蛋白リン酸化酵素のはたらきを調節することによってシナプス形成を活発にする新しい仕組みを明らかにしました。
シナプス形成において蛋白リン酸化酵素(*2)の一種であるMAPキナーゼ(MAPK, mitogen activated protein kinase)は、シナプスの材料となる蛋白分子を作ったり、作られたシナプスを安定化させたりするなど、幅広く重要な役割を担うことが知られています。しかしながら、これらの役割のなかでMAPKのはたらきがどのように調節されているのか、その正確な仕組みは解明されていませんでした。今回、研究グループは、非コードRNAがMAPKのはたらきを強くすることでシナプス形成を活発にすることを見出しました。本研究の成果は、神経ネットワークの要(かなめ)となるシナプスを作る新しい仕組みを解明しただけでなく、発達期のシナプス形成が正しくできないために発症するさまざまな神経発達障害の理解にも繋がると考えられます。
この研究成果は、米国科学雑誌「Journal of Cell Biology(ジャーナル・オブ・セル・バイオロジー)」に、オンライン版で2021年1月14日午前0時(報道解禁日時:米国東部標準時 1月13日午前10時)に掲載されました(冊子版には2021年2月1日発行2月号掲載)。
※研究グループ
国立精神・神経医療研究センター
神経研究所疾病研究第五部
部長 荒木 敏之、室長 若月 修二、研究補助員 柴田 恵、高橋 陽子
神経研究所疾病研究第三部
部長(研究当時)功刀 浩、室長(研究当時)沼川 忠広、研究員(研究当時)安達 直樹
研究の背景
神経細胞は細胞体から伸びる神経突起を介してお互いに連絡しています。私たちの脳には神経細胞が数百億個あり、それらが正しく連絡することで精密な神経ネットワークが作られ、さまざまな機能を発揮しています。この神経細胞同士が連絡する接点はシナプスと呼ばれ、言わば神経ネットワークの要(かなめ)となります。近年、発達期の神経ネットワーク形成への障害が、自閉症スペクトラム障害などの神経発達障害の発症や病態を理解するために非常に重要であると考えられるようになってきました。その主な理由は、神経発達障害の発症要因が多岐に渡るにも関わらず、それらの影響が発達期のシナプス形成の異常に集約されると考えられるからです。このような背景にあって、蛋白リン酸化酵素の一種であるMAPKはシナプス形成において中心的な役割を担うと考えられており、これまで活発に研究されてきました。しかしながら、この役割のなかでMAPKのはたらきがどのように調節されているのかなど、正確な仕組みの理解には至っておらず、未だ不明な点が多く残されています。
研究の概要
本研究グループは、シナプス形成に関わるさまざまな蛋白リン酸化酵素を調べるなかで、Aurora-Aという蛋白リン酸化酵素にシナプス形成を活発にするはたらきがあることを発見しました。Aurora-Aのはたらきを詳しく調べるため、神経細胞においてAurora-Aと直接結合する蛋白分子を探索したところ、リボ核蛋白質複合体Vault(ヴォールト)の主要構成因子である主要ヴォールト蛋白(MVP、major vault protein)が見出され、Aurora-AはVaultに結合してVaultをリン酸化することがわかりました。
Vaultは非コードRNA(アミノ酸情報をコードしていないRNA)の一種であるvault RNA(vtRNA)の他、MVPを含む複数の蛋白分子が集まってできたリボ核蛋白質複合体(*3)で、リボソームの8倍の体積を持つ、非常に大きく特徴的な構造をしています(図1)。これまでVaultはヒトをはじめとするさまざまな動物種で研究され、細胞のなかの幾つかの酵素反応を調節することが報告されています。しかしながら、脳におけるVaultの生理的役割の研究はほとんど進んでいませんでした。
脳の中ではAurora-AとVaultの結合・Vaultのリン酸化がいつ、どこでおこるのかを、マウスの脳組織を用いて生化学的に調べたところ、Aurora-AとMVPがシナプス後側(*4)においてお互いに結合していること、この結合が脳のなかでシナプス形成が活発になる時期に増加すること、などが確認されました。これらの結果から、Aurora-AとMVPがシナプス形成において何らかの役割を担うと考えてシナプス形成への寄与を検討したところ、Aurora-Aを多く発現させた神経細胞ではシナプス形成が活発になり、反対にリン酸化するはたらきをなくしたAurora-Aを発現させるとシナプス形成が低下することがわかりました。さらに、Aurora-Aがシナプス形成を活発にする効果はMVPと一緒に神経細胞に発現させることで強くなることもわかりました。
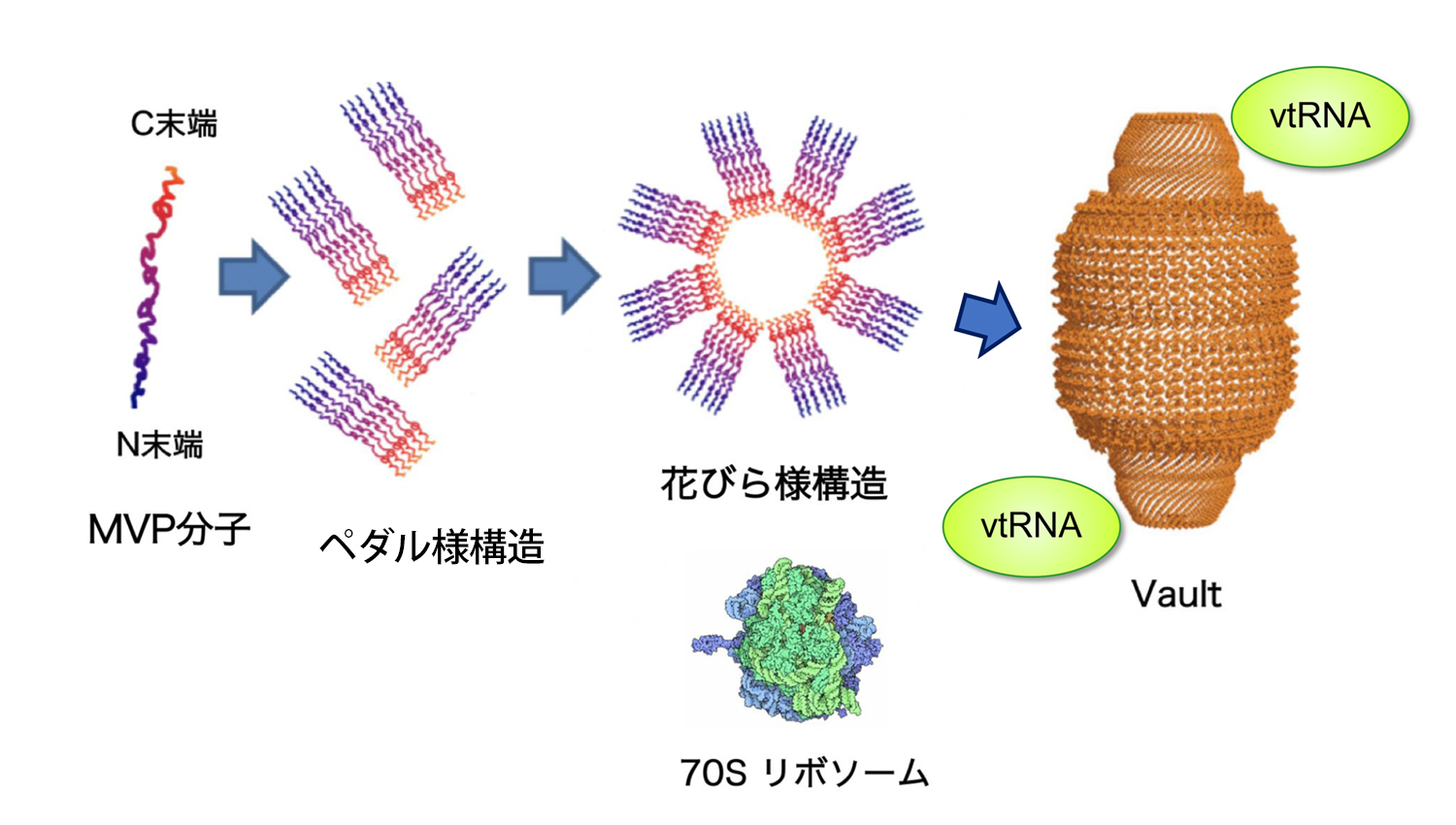
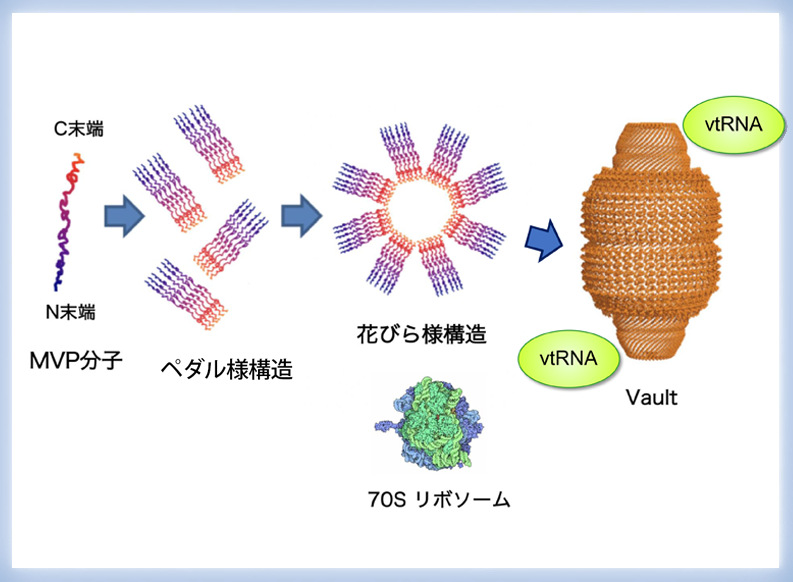
【図1】Vaultは巨大なリボ核タンパク質複合体である
Vaultの基本構造は2つの同じカップ状構造が結合した中空の樽状構造である。カップ状構造はMVP分子が会合したペダル様構造が花びら様構造をつくり、さらに折り畳まれてできると推定されている。この構造にMVP以外の幾つかの蛋白分子とvtRNA が会合し、リボソームの8倍の体積を持つ巨大なリボ核蛋白複合体Vaultとなる。
これらの結果から、Aurora-AによるMVPのリン酸化はシナプス形成を活発にすることと関連性があることが推測されました。
Vaultは非常に大きな構造のため遠心分離により沈殿しますが、Vaultの構造が解離(*5)すると沈殿しなくなり、Vaultを構成するMVPやvtRNAは上澄みに残るようになります。この性質を手がかりに詳しく調べると、蛋白リン酸化のはたらきを活発にさせたAurora-Aを神経細胞に発現させることにより、MVPやvtRNAが上澄みに残ることがわかり、MVPのリン酸化とVaultの解離との関連性が示されました。その一方で、vtRNAを発現させた神経細胞ではシナプス形成が活発になり、反対にvtRNAの発現を低下させるとシナプス形成が低下することも確認されました。これらの結果から、Aurora-AによるMVPのリン酸化をきっかけにVaultから遊離したvtRNAがシナプス形成を活発にする可能性が示されました。
近年、非コードRNAの一種が蛋白リン酸化酵素に直接作用して、そのはたらきを調節することが報告されています。先に述べたように、MAPKはシナプス形成の調節において中心的な役割を担うことなどから、研究グループはvtRNAがMAPKのはたらきを調節するのではないかという仮説を立てました。この仮説を証明するために、vtRNAとの分子同士の結合をRNA沈降法(*6)により調べたところ、vtRNAがMAPKのはたらきを調節するMEKと直接に結合することがわかりました。MEKはMAPKをリン酸化することでMAPKのはたらきを活発にする蛋白リン酸化酵素です。MEKによるMAPKのリン酸化反応は試験管内で再現でき、この反応系にvtRNAを共存させることでMEKによるMAPKのリン酸化が強くなることがわかりました。シナプス形成においてMAPKは、シナプスの材料となる蛋白分子を作る反応を活発にすることが知られています。本研究においても、Aurora-AやMVP、vtRNAを発現させた神経細胞の神経突起では活発に蛋白が作られ、またシナプス数も増加することが確認されています。以上の結果により、vtRNAがMAPKのはたらきを調節してシナプス形成を活発にするという、まったく新しいシナプス形成の仕組みが明らかになりました(図2)。
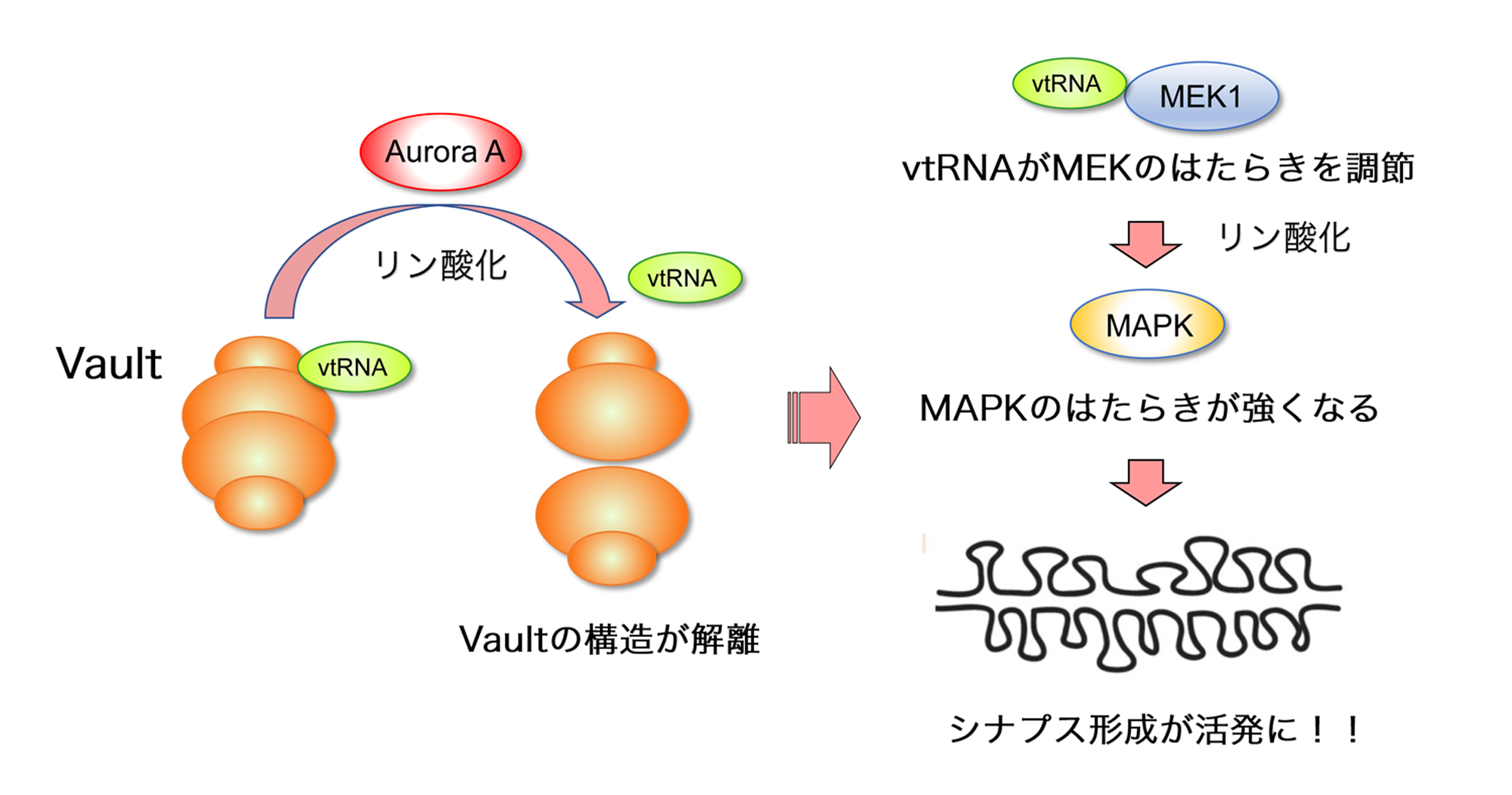
【図2】本研究が明らかにしたvtRNAによるシナプス形成メカニズム
蛋白リン酸化酵素Aurora-AによるMVPのリン酸化はVaultの構造を解離させ、遊離したvtRNAがMAPKのはたらきを調節してシナプス形成を活発にする。
今後の展望
MVPならびにMAPKをコードする遺伝子はヒト染色体16p11.2領域にあり、この領域の欠失は自閉症スペクトラム障害への感受性を増大させることが知られています。また近年、MAPKが学習と記憶などの脳の高次機能の調節に必要なこと、vtRNAの発現調節の異常が知的障害などの神経障害の発症と関連性があること、なども報告されています。これらの報告はいずれもVaultとその構成因子、そしてMAPKのはたらきが正しく調節されないことが、シナプス形成の異常につながる可能性を示していますが、正確な関連性の証明には至っていません。今回の研究結果は、vtRNAがMAPKのはたらきを調節してシナプス形成を活発にする仕組みを明確にしました。今後はこの研究結果を土台に、神経突起で遊離したvtRNAを上昇させるような薬剤などの同定により、新たな作用機序に基づく神経発達障害の治療法の開発が可能となることが期待されます。また、脳の発達におけるvtRNAの生理的役割の詳細を明らかにすることで、「非コードRNAを介するシナプス形成調節」という新しいパラダイムの創出につながると考えています。
用語説明
*1非コードRNA
蛋白質に翻訳されるmRNA(メッセンジャーRNA)に相対して付けられた、蛋白質に翻訳されないRNAの総称。古くは機能のないゴミのようなものと考えられていたが、近年、vtRNAのように生理的に重要な機能を持つことが明らかになっている。RNAの塩基配列には共通点は見られず、生理機能も多種多様である。
*2蛋白リン酸化酵素
リン酸基を付ける反応をリン酸化という。蛋白分子はアミノ酸がつながってできており、このアミノ酸のなかでセリン、スレオニン、チロシンをリン酸化する酵素を蛋白リン酸化酵素という。リン酸化によって蛋白分子の機能が変化したり、細胞内での局在が変化したりすることから、蛋白リン酸化酵素のはたらきは細胞の生存や機能調節に極めて重要である。
*3リボ核蛋白質複合体
RNA(リボ核酸)と蛋白分子の複合体である。代表的な例としては蛋白質の翻訳装置であるリボソームがある。
*4シナプス後側
シナプスは2つの細胞膜(シナプス前膜・シナプス後膜)からなり、向かい合った細胞膜同士の隙間をシナプス間隙と呼ぶ。神経ネットワークのなかの信号の伝わり方には決まった方向性があり、信号を送る側をシナプス前側、信号を受け取る側をシナプス後側と呼ぶ。
*5解離
分子などが集まって一つの分子のようになることを会合(かいごう)というが、反対に会合した分子同士の結びつきが弱まり、より小さい分子になることを解離という。
*6RNA沈降法
RNA沈降法は免疫沈降を応用した実験手法である。抗体によりRNA と結合する蛋白分子を免疫沈降して細胞や組織からその蛋白分子と一緒に結合するRNAを精製し、精製物に含まれるRNAを分析する。
原著論文情報
・タイトルSmall non-coding vault RNA modulates synapse formation by amplifying MAPK signaling
・著者名
Shuji Wakatsuki, Yoko Takahashi, Megumi Shibata, Naoki Adachi, Tadahiro Numakawa, Hiroshi Kunugi, Toshiyuki Araki
・雑誌
Journal of Cell Biology
・DOI
10.1083/jcb.201911078
助成金
本研究成果は、以下の事業・研究領域・研究課題によって行われました。
文部科学省科学研究費補助金:新学術領域研究 (2611173)、挑戦的萌芽研究(17K19945)
国立精神・神経医療研究センター精神・神経疾患研究開発費
お問い合わせ先
【研究に関する問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
神経研究所 疾病研究第五部
室長 若月 修二
E-mail:swaka(a)ncnp.go.jp
部長 荒木 敏之
TEL: 042-346-1716(荒木)
FAX: 042-346-1746
E-mail:taraki(a)ncnp.go.jp
【報道に関するお問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
総務課広報係
〒187-8551 東京都小平市小川東町4-1-1
TEL: 042-341-2711(代表) FAX: 042-344-6745
E-mail: ncnp-kouhou(a)ncnp.go.jp
※E-mailは上記アドレス(a)の部分を@に変えてご使用ください。