
2021年5月27日
国立研究開発法人 国立精神・神経医療研究センター(NCNP)
印刷用PDF(1.05MB)
小脳の神経前駆細胞・幹細胞の中に「違い」を作り出す機構の発見
―Notchシグナルによる小脳神経発達の新たなメカニズム―
国立研究開発法人国立精神・神経医療研究センター(NCNP)神経研究所病態生化学研究部足立透真研究生、星野幹雄部長らの研究グループは、生物の発生において最も重要なシグナル経路の一つであるNotchシグナルが、マウス小脳の神経前駆細胞(幹細胞)にわずかな「違い」を作りだし、その後の神経細胞の分化と小脳発達に重要な役割を果たしていることを明らかにしました。
哺乳類小脳の顆粒細胞は、全神経細胞のうち50%以上の割合を占める神経細胞です。その膨大な数の神経細胞は、顆粒細胞前駆細胞の爆発的な増殖および分化によって生み出されます。この顆粒細胞前駆細胞は見た目には均一な細胞集団に見えますが、それらの中には、分裂した後に再び分裂するものと、顆粒細胞へと分化するものが存在します。その割合は、発達途上で適切に制御されているように見えますが、その制御機構はいまだ未解明でした。
本研究グループは、インシリコのビッグデータ解析、培養細胞解析、遺伝子改変動物の解析などを行うことで、隣接する顆粒細胞前駆細胞の間でNotchシグナルの情報交換が行われていることを観察しました。そしてその情報交換によって、均一に見える前駆細胞の中に、「増殖能と未分化性がわずかに高いNotch-ON型」と「増殖能と未分化性がわずかに低いNotch-OFF型」という違いが作り出されることを明らかにしました。さらに、このNotchシグナルによって作り出されるわずかな違いが、その後の顆粒細胞を生み出すタイミングやその後の細胞分化に大きな影響を与えることも見出しました。そしてこの違いが、正常な小脳を作り上げるために重要な働きをしていると考えられました。
これらの発見は、正常な脳発達の分子基盤を理解する上で有意義な研究であるだけではなく、その分子基盤が破綻した結果生じる様々な脳疾患や脳腫瘍の病態解明や治療法の開発に繋がるものであると考えます。
本研究の成果は2021年5月26日に、科学雑誌「eNeuro(イーニューロ)」に掲載されました。
研究の背景
哺乳類小脳の顆粒細胞(*1)は、成熟した神経系において、全神経細胞のうち50%以上の割合を占める神経細胞であり、正常な運動機能の制御をはじめとする様々な重要な機能を持つ神経細胞です。顆粒細胞の前駆細胞である顆粒細胞前駆細胞(*1)は、小脳の最も外側の領域である外側外顆粒細胞層において分裂を繰り返し、適切なタイミングで顆粒細胞へと神経分化します。しかし、一様な細胞集団と思われているこの前駆細胞ですが、それらの中には、分裂した後に再び分裂するものと、顆粒細胞へと神経分化するものが存在します。その割合は、発達途上で適切に制御されているように見えるのですが、その制御機構はいまだ未解明でした。
Notchシグナルは脊椎、無脊椎動物を問わず、生物の発生の際に最も重要な細胞同士のコミュニケーションの一つです。一般的には、Notchリガンドを膜に提示した「シグナル送信細胞」とNotch 受容体を膜に提示した「シグナル受信細胞」間における隣接した二細胞間シグナルとして知られており、「シグナル送信細胞」になるか「シグナル受信細胞」になるかによって、隣接する細胞同士が異なる性質を持つことがわかっています。Notchシグナルのリガンドや受容体は、顆粒細胞前駆細胞、顆粒細胞においてもその発現が一部知られていましたが、前駆細胞/顆粒細胞内においてどのような働きを持っているのかは不明でした。
研究グループは、一様と思われていた前駆細胞集団内において、前駆細胞同士のNotchシグナルによる前駆細胞集団内に「違い」を生み出す制御機構が存在するのではないかと考え、研究を進めました。
研究の概要
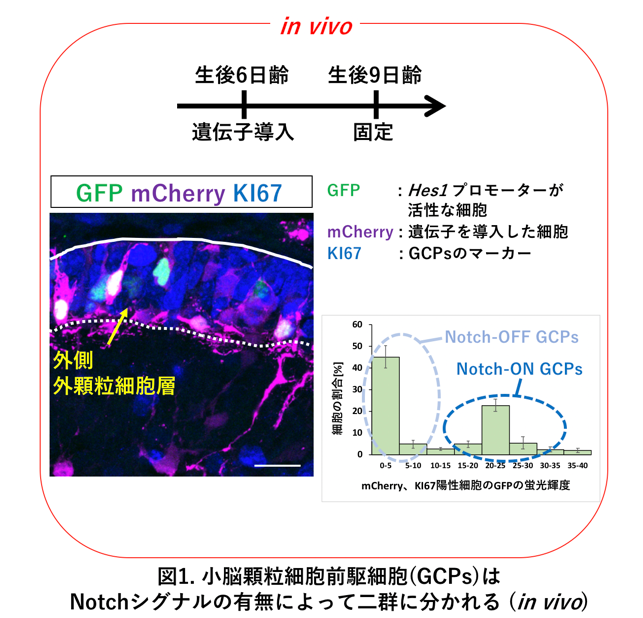
研究グループはまず、Notch関連分子のうち、リガンドであるJAG1、受容体であるNOTCH1とNOTCH2、そして受容体の下流で活性化する転写因子であるHes1が顆粒細胞前駆細胞において強く発現していることを見出しました。次に、Hes1プロモーターの下流でd2GFP(分解されやすい変異を導入された緑色蛍光タンパク質(GFP))を発現するプラスミドベクターを、発達途上小脳の前駆細胞に対して遺伝子導入しました(図1、上段の実験スケジュール)。この方法を使うと、Hes1遺伝子の発現状態を生体内でモニターすることが可能となり(図1、左下図)、その結果として前駆細胞内におけるNotchシグナルの強さを評価することができます。GFPの輝度によって、それぞれの前駆細胞におけるNotchシグナルの強度を調べてみると、前駆細胞の中に「ほとんどNotch活性を持たない前駆細胞」と「強いNotch活性を持つ前駆細胞」が見つかりました(図1、右下グラフ)。そして中間のGFP強度を持つ細胞はほとんど見つかりませんでした。そこで私たちは、この二種類の前駆細胞を「Notch-ON型前駆細胞」と、「Notch-OFF型前駆細胞」と名付けました(図1)。
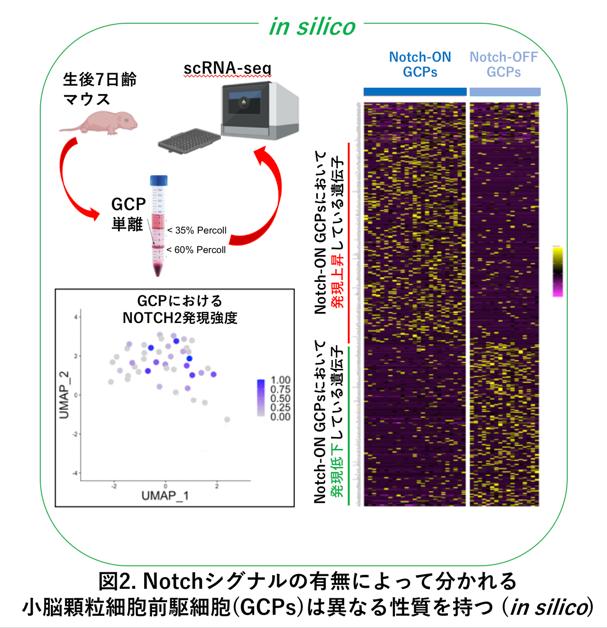
次に研究グループは、発達途上の小脳から顆粒細胞前駆細胞をFACSソーティングという方法を用いて、バラバラに分離しました(図2、左上図)。その前駆細胞に対してシングルセルRNAシーケンシング(*2)を行うことによって、それぞれ1個1個の顆粒細胞前駆細胞の中でどのような遺伝子が発現しているのかについてそれぞれの遺伝子のmRNA量を測定し、膨大なデータ(ビッグデータ)を得ることに成功しました。このビッグデータを高性能PCで解析(インシリコ解析と言います、図2)したところ、Notch-ON型前駆細胞は「未分化性と細胞増殖能が高い前駆細胞」であり、Notch-OFF型前駆細胞は逆に、「若干の分化傾向を持ち細胞増殖能が低い前駆細胞」であることがわかりました (図2、左下、右図)。
次に、研究グループは、ノックダウンベクターおよび過剰発現ベクターを遺伝子導入(電気穿孔法(*3))することで、小脳におけるNotchシグナル関連遺伝子であるNotch1, Notch2, Jag1, Hes1のそれぞれの遺伝子の機能を、抑制したり増強したりする実験を行いました。様々な組み合わせの遺伝子導入をした結果、以下のことがわかりました。
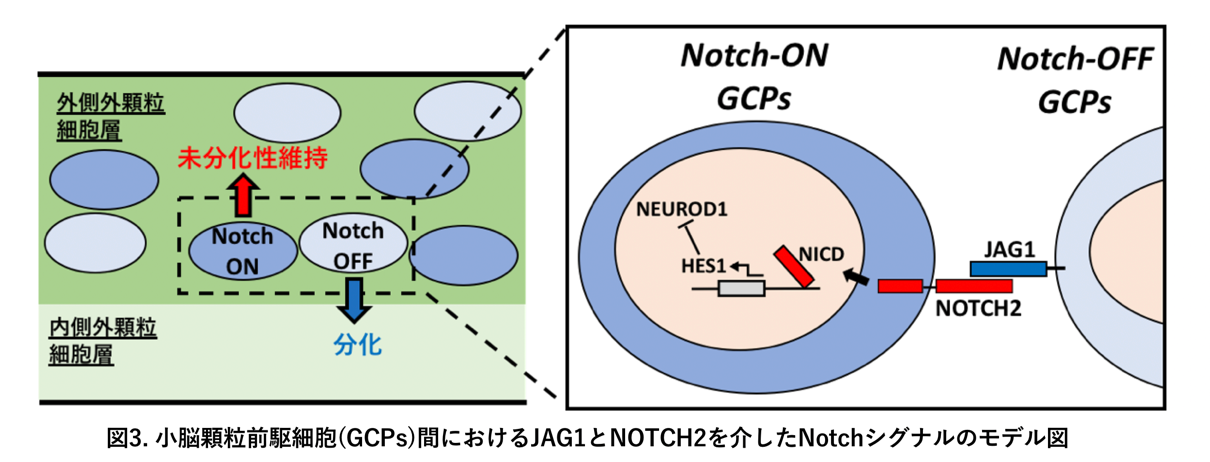
(i) 細胞表面タンパク質であるJAG1を発現する前駆細胞は、隣の前駆細胞の細胞表面タンパク質であるNOTCH2タンパク質と相互作用することで、隣の細胞におけるHes1遺伝子の発現を促進し、最終的には隣の細胞を「Notch-ON型前駆細胞」へと誘導する。その周囲の細胞は結果的に、未分化性が高く、細胞分裂を繰り返す前駆細胞に留まる。
(ii) JAG1を発現する前駆細胞は、自分自身はNotchシグナルを受け取ることができないため、「Notch-OFF型前駆細胞」となる。結果としていずれ細胞分裂が停止し、顆粒細胞へと神経分化することになる。
(iii) 前駆細胞から顆粒細胞への神経分化の過程には、NEUROD1という転写因子(*4)が関わることがこれまでにも示唆されていた。我々は、「Notch-ON型前駆細胞」では、HES1タンパク質が強く発現し、このHES1によってNEUROD1の発現が抑制されていることを見出した。一方で、「Notch-OFF型前駆細胞」ではHES1が発現していないので、結果としてNEUROD1の発現抑制が外れ、NEUROD1の発現が誘導されることがわかった。
(iv) すなわち、NotchシグナルのON, OFFによって、その前駆細胞内でのNEUROD1の発現がOFF、ONとなること、そしてその結果として、前駆細胞が増殖に留まるか、あるいは顆粒細胞へと神経分化するかが決められていることがわかった。
以上の結果から、(1)小脳の顆粒細胞の発生においてもNotchシグナルが働いていること、(2)このNotchシグナルの働きにより、均一に見える前駆細胞の中にわずかな違いが生み出されること、(3)そのわずかな違いが、前駆細胞から適切な時期に適切な量だけ顆粒細胞へと神経分化させるメカニズムとして働き、正しい小脳皮質の形成に寄与していること、がわかりました(図3)。
研究の意義・今後の展望
本研究はNotchシグナルが、一様と思われていた顆粒細胞前駆細胞の中で未分化な前駆細胞と、分化傾向にある前駆細胞という異なる二つのタイプの細胞を作り出し、顆粒細胞への適切な分化の制御に貢献しているシグナルであることを新たに示したものであり、正常な小脳発達の分子基盤を理解する上で重要な役割を示すものであると考えます。また、前駆細胞からの顆粒細胞への分化の異常は、小脳形成不全や、髄芽腫のような腫瘍を引き起こしてしまうことが知られています。本研究の発見は、Notchシグナルによる顆粒細胞前駆細胞の分裂・分化の制御機構が破綻した結果生じうる小脳疾患の病態解明や、治療法の開発にも繋がるものであると考えます。
用語の説明
*1・小脳顆粒細胞前駆細胞(Granule cell progenitors, GCPs)と小脳顆粒細胞(Granule cells, GCs)と小脳顆粒細胞
マウスにおいて、顆粒細胞前駆細胞は胎生17日目から生後15日目の間に小脳組織の最表面に存在する外側外顆粒細胞層を形成し、分裂を繰り返す。前駆細胞は分裂後、前駆細胞を生み出す場合と、顆粒細胞を生み出す場合があることがわかっている。顆粒細胞へと分化した細胞は、小脳の内側に落ち込んで行き、内顆粒細胞層にて、成熟した顆粒細胞となる。生後15日頃までには全ての前駆細胞が分化し、外顆粒細胞層は消失する。
*2・シングルセルRNAシーケンシング
次世代シーケンサーを用いて、個々の細胞が保持しているmRNAを網羅的に調べる方法。本実験では前駆細胞を単離してきた状態でシーケンシングにかけたことで、顆粒細胞前駆細胞がNotchシグナルの入力の有無によって、異なる性質を持った二つのサブグループに分けられることがわかった。
*3・電気穿孔法
電気パルスによって細胞膜の透過性を上げることで、DNAなどの分子を細胞に導入する手法。本研究では、マウスの小脳顆粒細胞前駆細胞に遺伝子を導入する手段として用いた。
*4・転写因子NEUROD1
顆粒細胞において高発現するタンパク質。転写因子として複数の遺伝子の働きを制御していることがわかっており、顆粒細胞前駆細胞の顆粒細胞への分化の際に必要な転写因子であることが既に知られている。
発表論文
・論文名:Notch signaling between cerebellar granule cell progenitors.
・著者:Toma Adachi, Satoshi Miyashita, Mariko Yamashita, Mana Shimoda,
Konstantin Okonechnikov, Lukas Chavez, Marcel Kool, Stefan M. Pfister, Takafumi Inoue, Daisuke Kawauchi, Mikio Hoshino
・掲載誌 : eNeuro
・DOI:10.1523/ENEURO.0468-20.2021
・https://www.eneuro.org/content/early/2021/03/23/ENEURO.0468-20.2021.long
助成金
本研究は、以下の事業・研究領域、研究課題によって得られました。
・文部科学省 科学研究費補助金 新学術領域研究 「個性創発脳」(16H06528)、
基盤研究(B) (18H02538)、若手研究(20K15919)、特別研究員奨励費(18J20309)
・国立研究開発法人日本医療研究開発機構(AMED)(JP20dm0107085h0001)
・Heidelberg Center for Personalized Medicine (H065)
お問い合わせ
[研究に関するお問い合わせ先]
星野 幹雄 (ほしの みきお)
国立精神・神経医療研究センター神経研究所 病態生化学研究部長
〒187-8551 東京都小平市小川東町 4-1-1
Tel : 042-346-1796 Fax: 042-346-1752
Email : hoshino(a)ncnp.go.jp
[報道に関するお問い合わせ先]
国立研究開発法人 国立精神・神経医療研究センター 総務課広報係
〒187-8551 東京都小平市小川東町 4-1-1
Tel : 042-341-2711 (代表) Fax: 042-344-6745
Email : ncnp-kouhou(a)ncnp.go.jp
※E-mailは上記アドレス(a)の部分を@にかえてご使用ください。




