2021年11月11日
公益財団法人 東京都医学総合研究所
国立研究開発法人 国立精神・神経医療研究センター(NCNP)
福祉保健局
印刷用PDF(1.1MB)
精神疾患の新たなリスク要因(砂糖の過剰摂取)と表現型(脳毛細血管障害)を発見
公益財団法人東京都医学総合研究所 睡眠プロジェクトの平井 志伸 主任研究員、 岡戸 晴生 シニア研究員、三輪 秀樹 協力研究員(国立精神・神経医療研究センター精神保健研究所精神薬理研究部 室長)らの研究グループは、思春期における砂糖の過剰摂取が精神疾患(本研究では統合失調症(注1)と双極性障害(注2)を指す)発症の新たな環境リスク要因となりうることを、新たなモデルマウスを作製することで実証しました。また、作製したモデルマウスを用いた詳細な検証により、精神疾患には脳の毛細血管障害及び、血中から脳内へのグルコースの取り込み障害が生じている可能性を見出し、前者に関しては実際の患者さんの死後脳においてもその存在の確認に成功しました。
統合失調症や双極性障害は、若年発症の難治性慢性疾患で発症メカニズムが不明のため、予防法、治療法が確立していません。様々な遺伝的要因のほか、環境要因も想定されていますが、脳機能を障害する確固たる原因は未だ同定されておらず、予防、治療法の確立が強く望まれています。
本研究グループは、精神疾患が好発する思春期における栄養環境に着目し、次の4点を明らかにしました。(図①)
- 思春期に砂糖を過剰摂取すると、背景に精神疾患に対する遺伝的な脆弱性を抱えていた場合に、様々な精神疾患様の症状を呈することを、新たにモデルマウスを作製することで明らかにしました。
- 上記のモデルマウスを詳細に解析する中で、脳の毛細血管障害という精神疾患の新たな表現型を見出しました。
- さらに、上記の脳の毛細血管障害のヒトでの一般性を検証し、統合失調症、双極性障害の患者さんの死後脳にモデルマウスと同様の血管障害を同定しました。
- 作製した精神疾患モデルマウスでは、血中から脳内へのグルコースの取り込みが低下していることを見出しました。
これらの成果は、精神疾患発症の背景に血管の障害による栄養素の取り込み低下といった代謝障害が潜在的に存在する可能性を示唆しており、今後、既存の神経伝達物質の受容体やトランスポータに対する創薬だけでなく、代謝制御といった新たな観点からの予防、治療法の開発が見込まれます。
本研究成果は、2021年11月11日(木曜日)午前4時(日本標準時)に米国科学誌『Science Advances』にオンラインに掲載されました。
<論文名>
” High-sucrose diets contribute to brain angiopathy with impaired glucose uptake and psychosis-related higher brain dysfunctions in mice”
<発表雑誌>
Science Advances
doi: 10.1126/sciadv.abl6077
URL: https://science.org/doi/10.1126/sciadv.abl6077
問い合わせ先
(研究に関すること)
睡眠プロジェクト:平井 志伸 主任研究員
電話:03-5316-3100(内)3822
メールアドレス:hirai-sn(a)igakuken.or.jp
(東京都医学総合研究所に関すること)
事務局研究推進課:武仲・大井
電話:03-5316-3109
※E-mailは上記アドレス(a)の部分を@に変えてご使用ください。
ポイント
- 思春期の砂糖の過剰摂取が精神疾患発症の新たな環境要因となりうることを発見しました。
- モデルマウスと実際の患者さんの死後脳を用いて、脳の毛細血管障害が新たな精神疾患の所見となることを見出しました。
- 血中から脳実質へのグルコースの取り込み障害が、精神疾患で生じている可能性を見出しました。
- 上記の発見により、精神疾患の発症背景に潜在的な代謝障害が存在することが提唱でき、新たな予防・治療法の開発につながると考えられます。
研究の背景
統合失調症や双極性障害などの精神疾患は若年発症の難治性慢性疾患で、複数の遺伝的要因と環境要因が重なり合って発症すると考えられているため、共通の発症機序の同定が難しく、予防・治療法が確立していません。特に統合失調症は、生涯を通じて病態の進行が続くケースも多く予防法・治療法の確立が強く望まれます。
本研究グループは、①精神疾患の患者は健常者よりも、過剰に砂糖などの糖質(注3)を摂取する、②砂糖をより過剰に摂取する統合失調症患者の予後が悪い、などの報告から、精神疾患発症と糖代謝障害の関連を疑い、『思春期における砂糖の摂取過多』という栄養環境に依存した新規の精神疾患モデルマウス作出の発案に至りました。
統合失調症や双極性障害などの精神疾患は『シナプス病』とも呼ばれ、脳の領域同士をつなぐ神経細胞ネットワークに異常があることが強く示唆されるため、長年シナプス関連遺伝子や、神経細胞機能にターゲットを絞った研究が主でした。本研究グループは、脳毛細血管の内皮細胞を含めたミクログリア(注4)、アストロサイト(注5)などの非神経細胞群の障害(糖代謝異常、炎症)に起因した、脳内のエネルギー不足が神経細胞の機能を低下させるという仮説を提唱しました。遺伝的に神経細胞に直接的な障害がなくとも、精神疾患が発症するメカニズムの解明の一旦になると考えます。
研究の内容
思春期の砂糖(グルコース(ブドウ糖)とフルクトース(果糖)からなる二糖)の過剰摂取は、背景に遺伝的リスクを伴うと、成長後の脳機能に影響を与えることを、マウスを用いて実証しました。つまり、栄養環境要因と遺伝要因が重なると、精神疾患様の症状を呈するマウスになりました。作出したモデルマウスは、精神疾患類似の行動、神経細胞機能障害、組織学的な表現型等を認めます。コントロール食として用いたデンプン含有食(グルコースのみが重合)では、野生型マウスでも、遺伝的な脆弱性を有するマウスでも顕著な異常は表出しなかったことから、砂糖や異性化糖 (注3)などの糖質を構成するフルクトース、もしくはフルクトースとグルコースを同時に思春期に多量に摂取することが、脳機能不全の原因と考えられます。
また、作出したモデルマウスを詳細に検証したところ、脳の毛細血管内皮細胞、ミクログリア、アストロサイトなどの非神経細胞群が異常所見を呈していました(糖代謝異常、炎症の所見)。また、モデルマウスでは血中から脳実質へのグルコース輸送が障害されていることも見出しました。発症前から、抗炎症剤の一種であるアスピリン(注6)を低濃度で継続的に投与しておくと、血管障害が抑制され、グルコースの取り込み障害や幾つかの異常行動も予防されました。この結果により、上記の細胞群の障害に伴う脳のエネルギー不足が、行動異常につながる神経細胞の不調を招いたと推察されます。
最後に、実際の患者においては脳の毛細血管障害の存在が報告されていなかったため、統合失調症、及び双極性障害の患者死後脳を用いて検証したところ、作出したモデルマウスと同様の所見を見出しました。注目すべきは、集めた患者死後脳は必ずしも砂糖の過剰摂取の記録を有するわけではなく、様々なストレス環境下で疾患を発症しているため、それらのストレスが血管障害に収斂している可能性を見出したということです。近年、社会敗北ストレスや、母子分離、ウイルス感染モデル動物において、脳の毛細血管障害が生じることが、我々の研究室も含めて次々と報告されています。これらのストレスは精神疾患の環境リスク要因とも重なるため、本研究グループにより見出された脳の毛細血管障害と精神疾患との関連性が、今後さらに検証すべき重要な課題であることが推察され、血管障害の改善により予防や治療が少しでも可能になることが期待されます。
主な研究成果は以下の4点です。
- 思春期に砂糖を過剰摂取すると、背景に精神疾患に対する遺伝的な脆弱性を抱えていた場合に、様々な精神疾患様の症状を呈することを、新たにモデルマウスを作製することで明らかにしました。
→ 精神疾患との関連が報告されているグリオキサララーゼ1(Glo1)(注7)に注目し、そのヘテロ欠損マウスに離乳期から砂糖過多食を与えて、以下の様な多数の精神疾患類似の表現型を見出しました。すなわち、プレパルス抑制能の低下、物体位置認識能の低下などの認知機能障害、さらに活動量の増加、毛繕い行動の異常亢進、巣作り行動低下などの行動異常を見出しました。統合失調症、双極性障害の治療薬として用いられるアリピプラゾールで上記行動異常の一部は改善されました。また、精神疾患患者で見られる、脳波異常、側坐核でのドーパミン過剰分泌、そしてパルブアルブミン陽性抑制性GABAニューロン(PV陽性ニューロン)不全(注8)も認められました。したがって、砂糖過多食による新たな精神疾患モデルマウスと考えられます。さらに、別の遺伝的リスク要因として統合失調症と双極性障害との関連が知られているDisc1(注9)遺伝子変異マウスでも砂糖過多食の給餌により、やはり認知機能低下などの行動異常を見出しています。したがって、思春期の砂糖過多食はヒトにおいても精神疾患の環境要因となる可能性があることが示唆されました。 - 上記のモデルマウスを詳細に解析する中で、脳の毛細血管障害という精神疾患の新たな表現型を見出しました。
→ 具体的には、脳の毛細血管の血管内皮細胞へのフィブリン(注10)の蓄積という特徴的な血管障害が見られました。なぜ血管障害が起こるのか、その機序は不明ですが、砂糖摂取過多による代謝障害や終末糖化産物(注11)産生などによるストレスが、遺伝的脆弱性の元で炎症を引き起こし、脳の毛細血管障害につながる可能性があります。 - 作製したモデルマウスは、血中から脳内へのグルコースの取り込み低下を伴っていました。
→ 本モデルマウスでは脳実質へのグルコース取り込み量が減弱していることを明らかにしました。さらに抗炎症剤であるアスピリンの事前投与により、脳の毛細血管障害は完全に、グルコースの取り込み低下は一部予防されました。それに伴いPV陽性ニューロン不全、ドーパミン分泌異常、いくつかの精神疾患様行動異常も予防されました。これは、精神疾患が脳の毛細血管障害によるグルコース取り込み障害に起因する可能性があるという新たな仮説を提起します。 - さらに、上記の脳の毛細血管障害のヒトでの一般性を検証し、統合失調症、双極性障害患者の死後脳にモデルマウスと同様の脳の毛細血管障害を見出しました。
→ 精神疾患で脳病理所見が新たに見出されることは殆どなく画期的な研究成果であると考えます。これまでの技術では、生体において脳の毛細血管障害を検出することができていません。将来それが可能となれば、早期発見、病態経過モニターが可能となり、精神疾患の克服に役立つと考えられます。
社会的意義・今後の展望
統合失調症の特効薬であるクロザピンが、ドーパミン受容体阻害効果が弱く、糖代謝、免疫系に作用を有することからも、本研究グループの仮説は、臨床現場でも支持されると考えられます。今後、脳の毛細血管障害の画像解析手法の開発、治療薬の開発によって、この仮説の検証が希求されます。
本研究では砂糖に着目しましたが、同じ構成成分である異性化糖の過剰摂取にも注意が必要と考えられます。健康に配慮した甘味料の摂取方法が普及していくことが期待されます。
参考図
図① 作出したモデルマウスの概念図
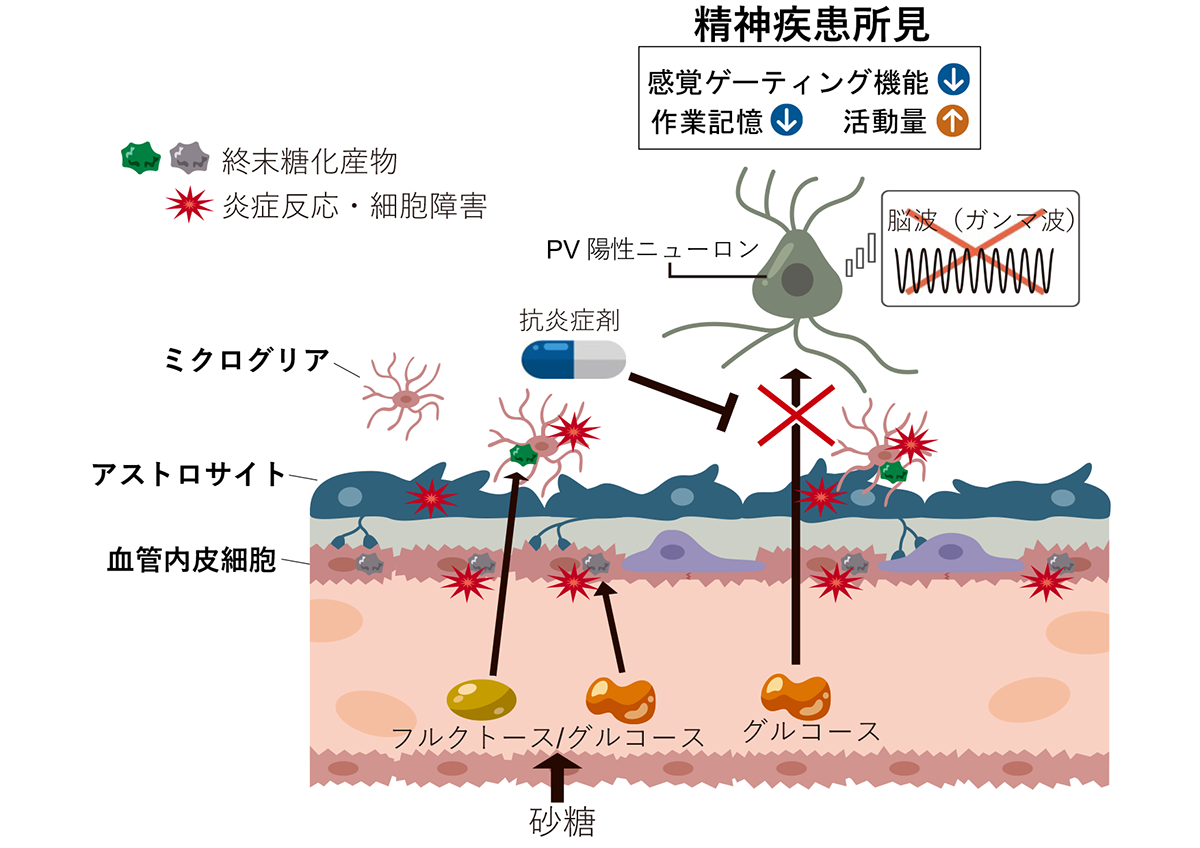
フルクトースとグルコースで構成される砂糖の思春期における過剰摂取は、非神経細胞群(ミクログリア、アストロサイト、脳の毛細血管内皮細胞)に炎症反応や代謝異常などの障害を引き起こし、血中から脳実質へのグルコース流入を妨げると考えられます。結果、精神疾患の主要症状を引き起こす特定の神経細胞(PV陽性ニューロン)の機能不全を招くと考えられます。
用語解説
(注1)統合失調症:思春期に発症する精神疾患で、人口の1%ほどが罹患します。幻聴を主体とした幻覚と妄想などの陽性症状、意欲減退、活動性の低下などの陰性症状に加えて、ワーキングメモリー低下などの認知機能障害が認められます。本研究で用いたアリピプラゾールなどの抗精神病薬が治療に用いられます。
(注2)双極性障害:思春期に発症する精神障害で、人口の1%ほどが罹患します。うつ状態と躁状態を繰り返し、重篤な場合、妄想が出現します。最近、認知機能障害が基本となる症状の1つであると考えられるようになってきました。気分安定薬の他、本実験で用いられたアリピプラゾールなどの抗精神病薬が治療に用いられます。
(注3)糖質:糖質は、複合糖質と単純糖質に分けられ、グルコース、フルクトース、砂糖と異性化糖は単純糖質に含まれます。異性化糖は、グルコースの一部を、酵素かアルカリによって異性体であるフルクトースに変換(異性化)して得られるグルコースとフルクトースの混合物であり、日本の食品の原材料名でよく果糖ブドウ糖液糖などと表記されます。1970年代より、砂糖の代わりに甘味料として広く使われています。一方、複合糖質は、本研究でコントロール食として使用した多糖類(でん粉など)を含みます。
(注4)ミクログリア:脳内の免疫系の細胞で、不要な老廃物や細胞を貪食します。近年、2割程度のミクログリアは血管と接して存在することが報告され、その意義が検証されつつあります。
(注5)アストロサイト:脳血管と共に血液脳関門を機能的に形成し、ニューロンへの栄養の運搬、ニューロンからの老廃物の除去等、ニューロン機能を支えるグリア細胞の一種です。その数ニューロンの10倍以上。
(注6)アスピリン:アセチルサリチル酸メチルのことで、非ステロイド型抗炎症剤として抗炎症作用、解熱、鎮痛作用を示します。低用量では血小板活性化阻害作用があり、血栓予防効果を示します。
(注7)Glo1:Glyoxylase-1 (Glo1) 遺伝子はグルタチオンを利用し終末糖化産物の元になるメチルグリオキサールを、乳酸合成の方へと代謝経路を変換させる酵素です。糖尿病や精神疾患(統合失調症、双極性障害、大うつ病)患者において、その発現や活性が低下していることが報告されています。
(注8)パルブアルブミン陽性抑制性GABAニューロン(PV陽性ニューロン)不全: 近年、統合失調症や双極性障害においてこのニューロンの機能障害と認知機能との相関が次々に明らかとなり注目されています。このニューロンが活動すると、下流のニューロンの活動が適宜抑制され、その抑制のリズムと同じ周波数の脳波が検出されます。
(注9)DISC1:Disrupted In Schizophrenia-1( DISC1)遺伝子は、大脳新皮質や海馬の神経発達、シナプス制御に関わる多くの遺伝子と結合し働くことが知られています。元々、スコットランドの精神疾患多発家系(統合失調症、双極性障害、大うつ病)から見出されました。Disc1変異マウスは、様々な環境要因と組み合わせることで精神疾患モデルマウスとして利用されています。
(注10)フィブリン:肝臓で産生され、血液中に流れているフィブリノーゲンが分解されフィブリンとなり、血小板とともに重合し、止血や血栓形成に中心的な役割を持っています。物理的な障害だけでなく、感染、慢性炎症などといった様々な異常状況において血管内皮細胞に蓄積するため、血管内皮細胞の障害マーカーとなると考えられています。
(注11)終末糖化産物:Advanced glycation end products (AGEs)のこと。AGEは糖などのカルボニル基を有する化合物とタンパク質などが有するアミノ基が、非酵素学的に反応し形成されます。文字通りこれ以上分解も反応もしない化合物で、生体には異物と判断され炎症反応の起点となることがあります。細胞内で生成されるAGEsとしては、特に糖代謝中間体に由来するグリセルアルデヒドやメチルグリオキサール由来のAGEsがあり、疾患(精神疾患、糖尿病性合併症、動脈硬化、神経変性疾患など)の発症や進展に関わっていると考えられています。
本研究は、国立精神・神経医療研究センター、福島県立医科大学、東京理科大学、富山大学、湘南医療大学、東北大学、トロント大学、大阪大学、当研究所の統合失調症プロジェクト、基盤技術センター、学術支援室との共同研究です。
本研究の主な助成事業
日本学術振興会(JSPS)科学研究費基金・若手研究「遺伝的素因と食環境との相互作用による精神疾患発症の実験的証明」(18K14832)、日本学術振興会(JSPS)科学研究費基金・基盤研究(B)「脳高次機能の発達と老化の制御に共通する分子機構の解明」(18H02537)、糧食研究会・一般公募研究、武田科学振興財団・医学系研究助成、Japan Prize Foundation・研究助成、公益財団法人金原一郎記念医学医療振興財団・基礎医学医療研究助成金の支援を受けました。