2022年9月9日
国立研究開発法人 国立精神・神経医療研究センター(NCNP)
印刷用PDF(462KB)
自己反応性ヘルパーT細胞の識別マーカー分子の同定
~副作用のない自己免疫疾患の根本治療への道を拓く新たな成果~
<ポイント>
・自己免疫疾患で中心的な役割を果たすT細胞のNR4A2遺伝子を欠く自己免疫疾患モデルマウスは、病態が改善し、さらに、通常の免疫応答が保たれていた。
・NR4A2の欠損により自己反応性のTh細胞集団が減少し、その選択的識別マーカー分子としてNrp-1を発見した。
・Nrp-1を標的とした自己免疫疾患の治療により、モデルマウスの病態が有意に改善した。
・ヒトの自己免疫疾患患者でも、Nrp-1を発現するTh細胞集団の増加が認められた。
国立精神・神経医療研究センター(NCNP)神経研究所免疫研究部の大木伸司室長、山村隆特任研究部長、ベン・レイバニー研究員らの研究グループは、北里大学医学部の有沼良幸准教授、山岡邦宏教授、東京大学大学院薬学系研究科の堀昌平教授らとの共同研究により、種々の自己免疫疾患の病態形成において中心的な役割を果たす自己反応性ヘルパーT細胞集団の識別マーカー分子としてNrp-1発見し、関連の研究成果を発表しました。
研究成果は、「EMBO Molecular Medicine」オンライン版に日本時間2022年9月7日午前13時(米国東部標準時間 9月7日0時)に掲載されました。
研究の背景
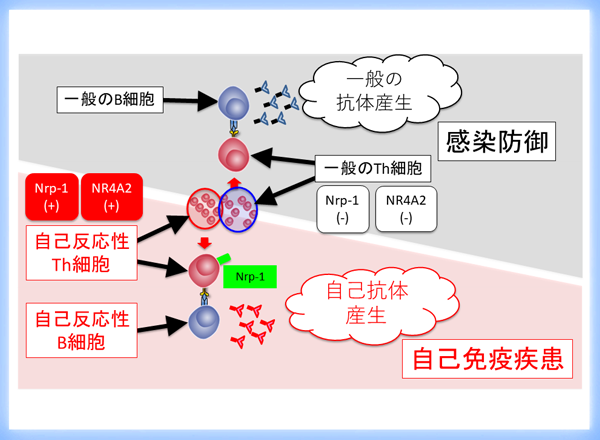
自己免疫疾患は、免疫系が生体防御の対象であるホストの構成成分を異物と見なし、これを攻撃することで生じます。その際、ホストの構成成分を認識する自己反応性ヘルパーT(Th)細胞が司令塔として、病態を直接引き起こしたり、抗体をつくる元となるB細胞からの自己抗体産生を促し間接的に発症に関わります。自己抗体依存性の疾患のなかでも、視神経脊髄炎(NMO)や重症筋無力症(MG)のように自己抗体の病原性が明確な疾患がある一方で、コントロールが難しく、難治である全身性ループスエリテマトーデス(SLE)の多様な自己抗体の病原性はほぼ不明です。自己免疫疾患の治療に長年使われてきたステロイドや免疫抑制剤に加えて、最近では炎症性サイトカインやB細胞を標的としたより特異性の高い治療法が開発されています。しかしこれらの方法では免疫応答が全体的に抑制されるため、生体防御機構としての免疫系の働きも減弱し、外部からの感染に対する抵抗性が弱まることがあります。また一時的に症状が改善しても、自己抗体産生の元となるB細胞が再度増えれば症状が再燃するため、根本的な治療効果が得られるとは限りません。
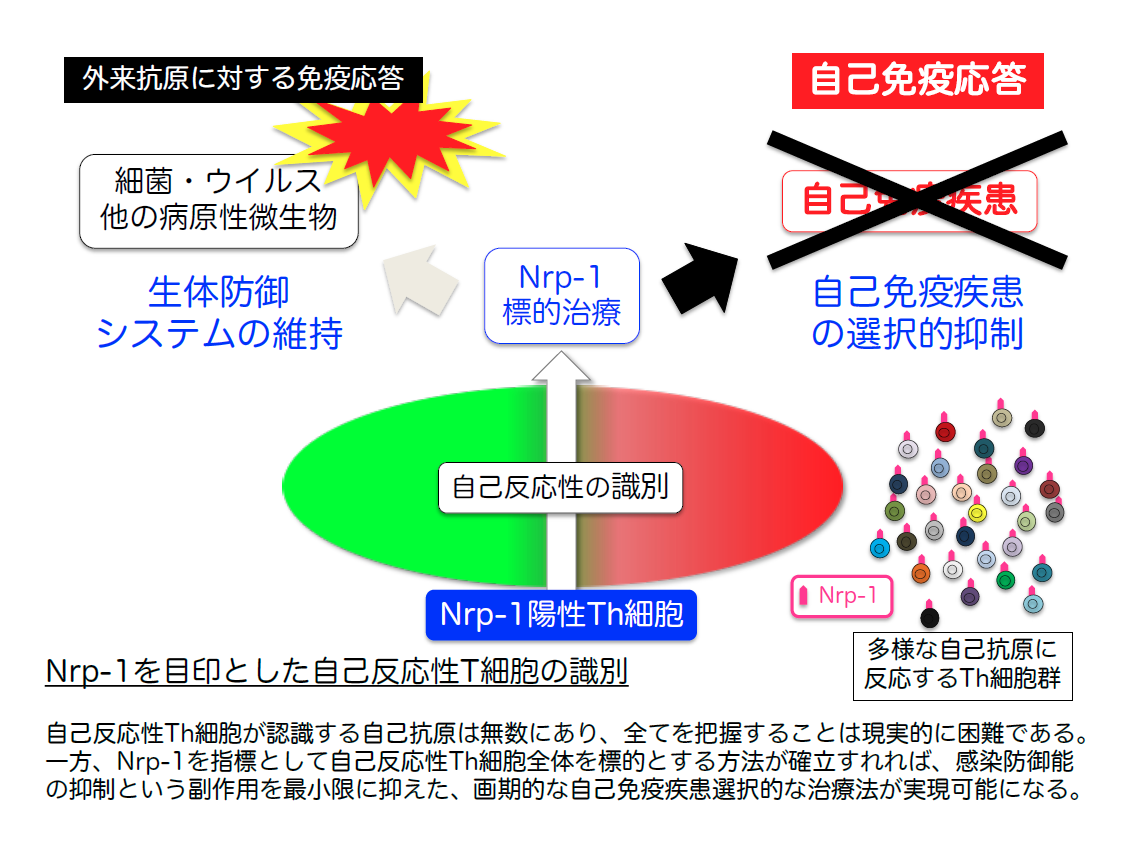
自己抗体産生には、B細胞と同じ自己抗原を認識する自己反応性Th細胞が必要です。よって自己反応性Th細胞を識別し、選択的に排除することができれば、自己免疫応答の大元を抑え込む自己免疫疾患の根本治療への道が開けます。加えて自己反応性Th細胞に限局した介入をしても、通常の免疫応答は影響を受けないと予想され、外部からの感染への抵抗性を維持し自己免疫疾患のみを標的とした理想的な治療法が実現できます。そこで疾患ごとに自己抗原を同定して、その反応を選択的に抑え込む方法が試みられていますが、自己免疫疾患における自己抗原の役割はとらえどころがなく、この様な治療法の実現可能性は今のところ未知数です。しかし、自己反応性T細胞の特異的な識別法があれば、抗原とは無関係に自己免疫疾患のみを抑制することができますが、これまで雑多な細胞集団の中から自己反応性T細胞を見分ける方法はありませんでした。今回、研究グループは、この自己反応性ヘルパーT細胞サブセットの新しい分子マーカーとしてNrp-1を同定することに成功し、副作用のない自己免疫疾患の根本治療への道を拓く新しい研究成果を発表しました(下図)。

研究の概要
研究グループは、多発性硬化症患者(MS)とその動物モデルである実験的自己免疫性脳脊髄炎(EAE)の病態解析から、病原性Th細胞においてNR4A2分子が重要な役割を果たすことを以前に見つけていました。MS/EAEでは、Th17細胞の表現型を獲得した自己反応性Th細胞が病気を引き起こします。研究グループは、マウスが自己抗原に晒された時にのみ、T細胞のNR4A2発現が増加するというデータを手がかりとして、NR4A2が自己反応性Th細胞の機能に重要な役割を果たすと予想しました。これを検証するために、SLE様の病態を自然発症するBXSB-Yaaマウス背景のNR4A2cKO(BXSB)マウスを樹立したところ、脾臓やリンパ節の腫大や、血清中の総IgG量及びIgG2a抗体量の顕著な増加が、強く抑制されました。さらに血清中の抗核抗体を含む自己抗体量もNR4A2cKO(BXSB)マウスでは顕著に抑制されており、抗原抗体複合体の沈着による糸球体腎炎様の所見も著しく改善していることがわかりました。NR4A2cKO(BXSB)マウスでは、抗体産生に関わるTfh細胞(PD-1+CX3CR5+)とTph細胞(PD-1+CX3CR5-)が共に低下していました。病態への寄与は、Tfh細胞よりTph細胞の強い傾向を認めましたが、どちらかのみが関与するということはありませんでした。興味深いことに、外来抗原に対するNR4A2cKO(BXSB)マウスの免疫応答には異常が認められず、NR4A2が自己反応性Th細胞に限局して機能していることが示されました(下図)。
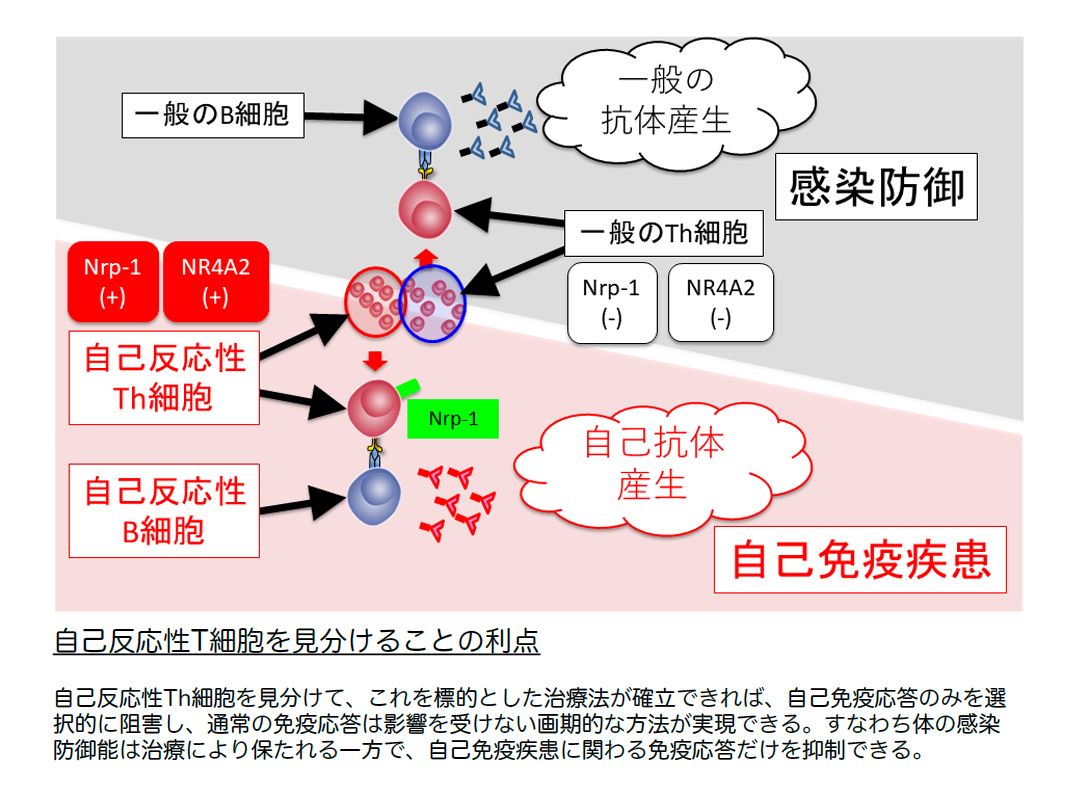
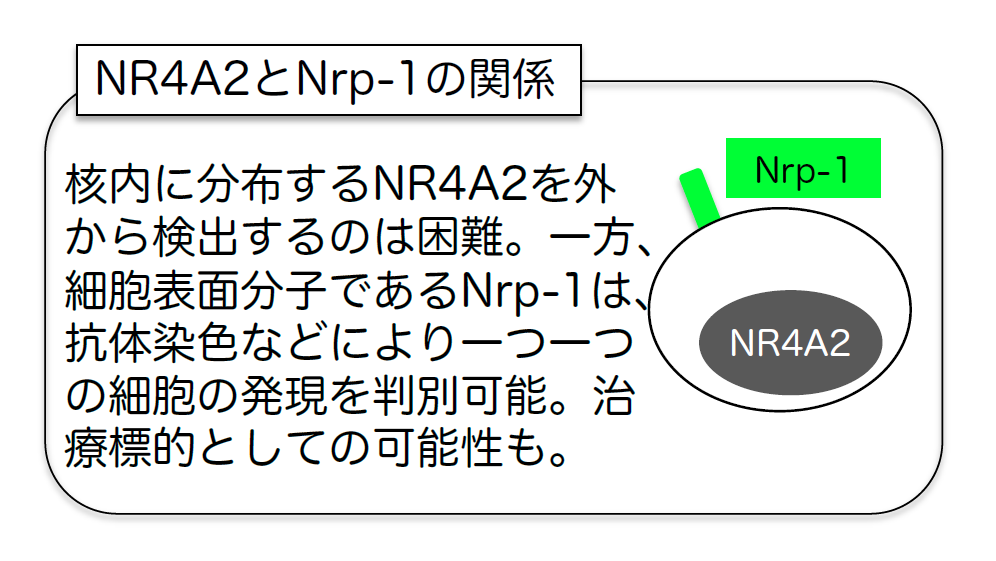
T細胞受容体(TCR)の特定のアミノ酸配列が、T細胞の自己反応性の判定基準になることが報告されています(Nat Commun 2016)。そこで研究グループは、NR4A2cKO(BXSB)マウスと対照マウスの脾臓Th細胞のTCRの配列解析を行いました。その結果、NR4A2cKO(BXSB)マウスでは、自己反応性Th細胞が選択的に減少した一方で、その他のTh細胞は維持されていました。したがってNR4A2が、自己反応性Th細胞の機能制御分子であることが明らかとなりました。次に研究グループは、発症に伴って増加し、NR4A2遺伝子の欠損により低下するTh細胞サブセットの探索を行いました。その結果、Nrp-1分子が自己反応性Th細胞の選択的なマーカー分子であることを見出しました(「NR4A2とNrp-1の関係」参照 )。このNrp-1陽性の自己反応性Th細胞は、正常マウスにはほとんど存在しませんが、発症後のBXSB-Yaaマウスでは爆発的に増殖しており、脾臓重量、血清総IgG、抗核抗体量とよく相関します。その一方で、NR4A2cKO(BXSB)マウスではNrp-1陽性Th細胞は顕著に減っていました。興味深いことにNrp-1陽性Th細胞は、別のSLEモデルマウスであるMRL-lprマウスや、自己反応性Th細胞の除去システムに異常を持つAire遺伝子欠損マウスでも有意に亢進しており、自己反応性T細胞のマーカー分子としての重要性が裏付けられました。
次に研究グループは、Nrp-1陽性Th細胞の病原性と、同細胞を標的とした自己免疫病態治療の有効性の検証を行いました。まずBXSB-Yaaマウスから分離したNrp-1陽性Th細胞を別のマウスに移植したところ、移植マウスでは脾臓が有意に大きくなり、血清IgG量および抗核抗体量も増加しました。よって、以上のことから、Nrp-1陽性Th細胞が確かにSLE様の自己免疫疾患を引き起こす原因であることがわかりました。Nrp-1は、特定のがん細胞に対するドラッグデリバリーシステムの標的分子として注目されており、複数のNrp-1標的ペプチドが知られています。そこでNrp-1結合モチーフとアポトーシス誘導モチーフからなる合成ペプチド(RPAペプチド)をBXSB-Yaaマウスに投与したところ、脾臓重量、血清IgG量および抗核抗体量がいずれも顕著に改善し、Nrp-1陽性Th細胞の頻度も有意に低下することがわかりました。以上の結果から、Nrp-1を高発現した自己反応性Th細胞を標的とした予防的あるいは治療的介入により、自己免疫病態の有意な改善が得られることが明らかとなりました。
最後に研究グループは、このNrp-1陽性Th細胞が、ヒトの自己免疫疾患でも同様の挙動を示すかどうかを調べました。健常人のNrp-1陽性Th細胞の頻度はおおむね1%未満でしたが、SLEではNrp-1陽性細胞頻度が有意に亢進した患者が複数認められ、ヒトの自己免疫疾患に関連したNrp-1陽性Th細胞の有意な増加が確認されました。以上の結果から、Nrp-1陽性細胞の増加は自己免疫疾患と密接に関連したイベントであり、一連の研究結果がヒトの自己免疫疾患でも再現できることが明らかとなりました。
今後の展望
1つのT細胞が、特定の抗原に反応するかどうかは容易に判定できますが、そのT細胞が反応しうる抗原全体を捉えることは極めて困難です。がん免疫の研究領域では、がん関連抗原に特異的なTCR遺伝子改変T細胞を用いた治療の試みが行われていますが、あくまでも抗原が確定していることが前提となります。これまで自己免疫疾患における自己抗原の性状解析は、モデル動物の研究を除いてはほとんど進んでおらず、将来的に特定の自己抗原に反応するTh細胞の機能抑制が実現可能かどうかも不明です。一方、今回の研究グループの成果によれば、Nrp-1発現がTh細胞の自己反応性を規定する極めて有用なマーカー分子として、自己反応性Th細胞の識別や治療標的などに応用可能なことが示されました(下図)。
今後、他の自己免疫疾患におけるNrp-1陽性Th細胞の挙動を順次解析し、今回の研究成果がより広範な疾患に適用可能であることを示していくとともに、種々の自己免疫疾患の病勢を推測する診断マーカーおよび治療反応性マーカーとしての応用可能性についても検証していくことが期待されます。一方、Nrp-1を標的とした自己反応性Th細胞の制御法が確立すれば、MSの様にT細胞が主体の疾患に対する直接的な治療に加えて、既存のB細胞標的治療法にアドオンすることで、抗体依存性の自己免疫疾患に対してもより長期の寛解導入が期待できます。生体防御に関わる免疫応答の本来の機能への影響は最小限と考えられるため、感染症への抵抗性を維持しつつ、自己免疫病態のみを標的とした、より効果的で副作用の少ない理想的な治療法の実現が期待されます。
用語説明
注1)NR4A2
ヒトでは48種類の遺伝子が存在する核内受容体ファミリー分子の一つであり、nurr1とも呼ばれる。NR4AファミリーはNR4A1、NR4A2、NR4A3の3種から構成され、免疫系においては制御性T細胞の機能制御に中心的な役割を果たす。ただしその寄与の程度はNR4A1>NR4A3>NR4A2の順に減少していき、制御性T細胞の機能とNR4A2の関係は必ずしも明らかではない。
注2)全身性ループスエリテマトーデス(SLE)
SLEは、原因不明の全身性自己免疫疾患であり、全身性紅斑性狼瘡とも呼ばれる膠原病の一つである。何らかの原因による自己免疫応答の結果として産生される種々の自己抗体が、全身の炎症製造機障害を起こすことで重篤な症状を引き起こす。これまでSLEにおいては100種類を超える多様な自己抗原が報告されているが、個々の抗原の病原性は必ずしも明確ではない。自己抗体と結合して生成する抗原抗体複合体が、腎糸球体などに沈着することで誘発される糸球体腎炎や腎不全が予後に大きく影響する。っさらに、SLE患者の多くは神経症状を呈することが知られているが(NP-SLE)、その原因はほぼ不明である。自己抗体依存性の種々の中枢神経疾患においても、類似の発症機序が関わると考えられているが、中枢神経症状の病因究明は困難であり、いまだにステロイド投与などの古典的治療が主流である。
注3)病原性Th細胞と自己反応性Th細胞
病原性Th細胞は、何らかの病態の原因となるTh細胞集団を指し、多発性硬化症をはじめとする多くの自己免疫疾患では、Th17細胞が病原性Th細胞の代表格とされており、IL-17やRORtの発現を指標としてその存在が示される。一方、自己反応性Th細胞は、自己免疫応答に関わる正真正銘の原因であり、Th17細胞、Tfh細胞やTph細胞のそれぞれに分布する。このように病原性Th細胞と自己反応性Th細胞は縦糸と横糸の関係にあるが、これまで自己反応性Th細胞を識別し、これを制御する方法は存在しなかった。
注4)T/B相互作用とT細胞ヘルプ
多くの自己抗体を含むIgG抗体の産生細胞が生じるためには、同じ自己抗原を同時に認識するT細胞の助けが必要である (T細胞ヘルプ)。Tfh細胞は、この様な抗体産生細胞の分化を促進する機能を獲得した代表的な細胞集団であり、B細胞に様々な刺激を与えることで抗体産生細胞を生成させる。この反応は自己抗体産生の場合も同じ様に必要であり、その背後には同じ自己抗原を認識する自己反応性Th細胞が存在する。
注5)Tfh細胞&Tph細胞
抗原感作で誘導される二次リンパ組織内のリンパ濾胞内部で、B細胞と相互作用してその分化と胚中心の形成を引き起こすT細胞を、follicular helper T(濾胞ヘルパーT; Tfh)細胞と呼び、B細胞領域への移行にはTfh細胞が発現するCXCR5が必須である。一方、濾胞外でのB細胞分化誘導に関わるヘルパーT細胞を、peripheral helper T(Tph)細胞という。一般に、Tfh細胞とTph細胞は、細胞表面のCXCR5発現を指標に区別されるが、抗体産生反応におけるこれら2種類のTh細胞の役割の違いやTfh細胞とTph細胞のいずれが自己免疫疾患の発症と関連するかは明らかではない。
原著論文情報
・タイトル
Neuropilin-1 (Nrp-1) expression distinguishes self-reactive helper T cells in systemic autoimmune disease
・著者名
Ben JE Raveney, Yosif El-Darawish, Wakiro Sato, Yoshiyuki Arimura, Kunihiro Yamaoka, Shihei Hori, Takashi Yamamura, Shinji Oki
・雑誌
EMBO Molecular Medicine
・DOI; 10.15252/emmm.202215864
・https://doi.org/10.15252/emmm.202215864
助成金
本研究成果は、以下の事業・研究領域・研究課題によって行われました。
・日本医療研究開発機構・難治性疾患実用化研究事業(AMED)
・文部科学省科学研究費補助金
・日本医療研究開発機構・革新的先端研究開発支援事業(AMED-CREST)
・国立精神・神経医療研究センター精神・神経疾患研究開発費
お問い合わせ先
【研究に関する問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
神経研究所 免疫研究部
室長 大木 伸司
TEL: 042-341-2711(代表) FAX: 042-346-1753
E-mail: soki(a)ncnp.go.jp
【報道に関するお問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
総務課広報係
〒187-8551 東京都小平市小川東町4-1-1
TEL: 042-341-2711(代表) FAX: 042-344-6745
E-mail: ncnp-kouhou(a)ncnp.go.jp
※E-mailは上記アドレス(a)の部分を@にかえてご使用ください。