2023年10月11日
国立研究開発法人 国立精神・神経医療研究センター(NCNP)
印刷用PDF(1.4MB)
再発しない多発性硬化症の分子基盤を解明
多発性硬化症(MS)は再発を繰り返しながら悪化していく難治性の自己免疫疾患ですが、発病時の病態は重症であっても、その後は再発しないケースもあります。頻回の再発のために高度の障害を残すケースもあるなかで、なぜ一部の患者さんは再発しないのかという基本的な疑問について、これまで明確な答は用意されていませんでした。今回、国立精神・神経医療研究センター(NCNP)神経研究所免疫研究部の研究グループは、マウスの実験で、MSのモデル自己免疫性脳炎(EAE)が再発を繰り返して慢性化するか、または再発しないかを決定する原因を探索しました。研究の結果、EAEの誘導に使うペプチドと主要組織適合抗原クラスII分子(MHC class II)の結合安定性がきわめて重要な要因であることを明らかにしました。研究成果は「Journal of Autoimmunity」オンライン版に2023年9月14日(日本時間)に掲載されました。
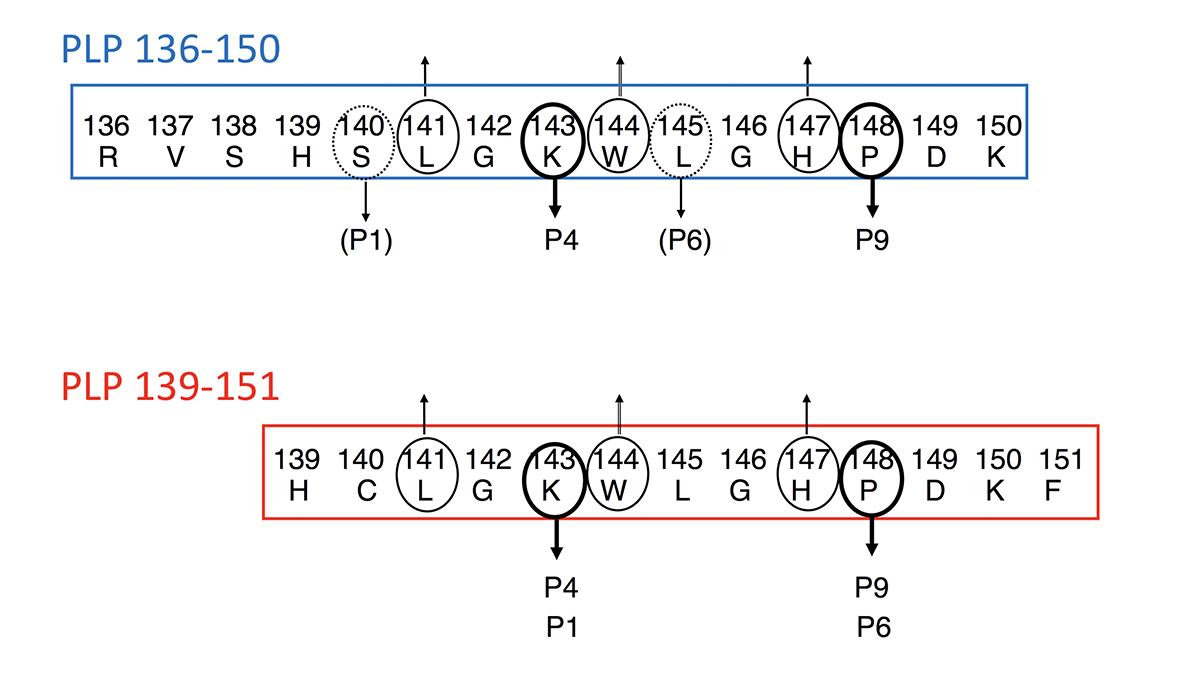
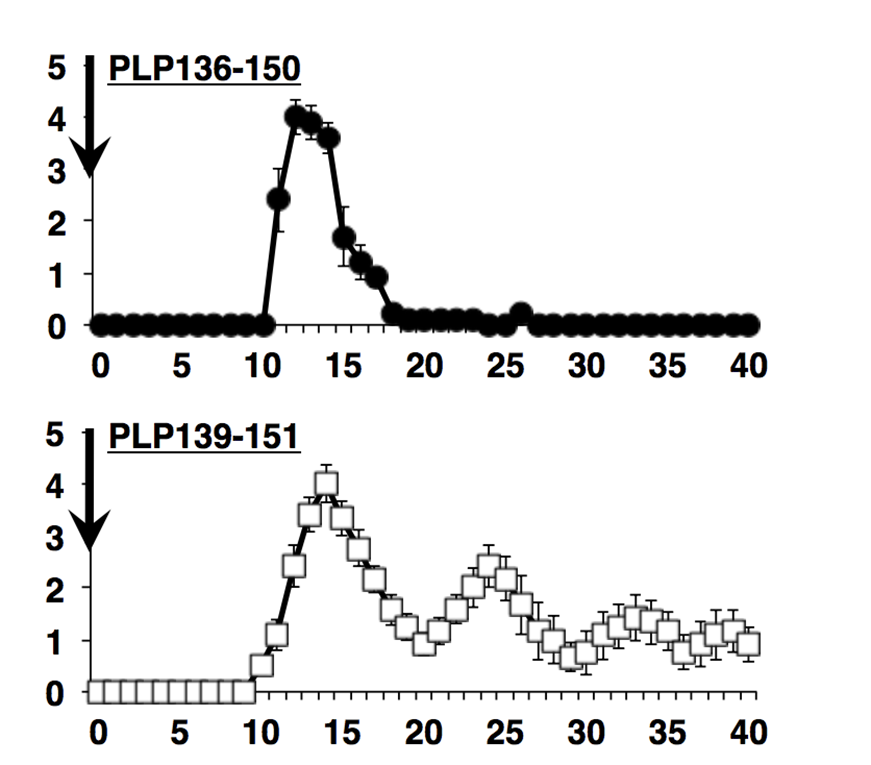
筆頭著者である林幼偉(りん・ようい)研究員は、髄鞘(ミエリン)抗原であるプロテオリピッドPLP 139-151(図1)をEAEの誘導のためにマウスに接種すると、再発寛解型MSに似た再発性の脳脊髄炎(EAE1))が誘導されるのに対して、PLP139-151と12個のアミノ酸が共通しているPLP136-150ペプチドを接種すると、最初に強い麻痺症状が起きるが、再発しない脳脊髄炎を誘導できることを確認し(図2)、一見同じように見える、この二種類のペプチドの何に違いがあるのか解析を進めました。林研究員は、PLP136-150の方がPLP139-151よりも自己免疫性炎症を抑制する抗原特異的な制御性T細胞2)を強く誘導するために、病気の再発が起こらないことを免疫学的な手法で証明しました。さらに共同研究者の櫻庭俊博士(量子化学技術研究開発機構)は、PLP136-150 とPLP139-151のMHC class II 結合能に関する動的構造解析の結果、PLP136-150に比べてPLP139-151のMHC class II分子への結合が不安定であることを詳細なin silico解析で明らかにしました。
これらの結果は、ペプチドとMHC class IIの結合が安定しているほど、抗原特異的制御性T細胞が誘導されて再発が起こらなくなることを支持するものです。PLP136-150 とPLP139-151両ペプチドはMHC class IIに同じアミノ酸を使って結合していると想定されるにもかかわらず(図1)、それぞれのMHC class II結合安定性が大きく異なることは予想外の結果でしたが、それはMHC class II がペプチドを結合する溝 (MHC groove)の外にはみ出たアミノ酸配列がペプチドとMHC間の水素結合に影響を与えるからであることもわかりました。また研究チームは、強い炎症抑制能を有する制御性T細胞を同定するマーカー(CD69陽性, CD103陽性, CD25 強陽性)も同定しました。
研究の背景
EAEの症状や臨床経過は、誘導に用いるペプチドとマウス種類の組み合わせによって異なります。例えばB6マウスにMOG 35-55ペプチドを接種すると進行性で回復に乏しい麻痺症状のEAEが誘導されます。一方で、SJL/JマウスにPLP139-151ペプチドを接種すると、最初の麻痺症状は回復しても再発を繰り返します。PLPがEAEを誘導することを最初に証明したのは、当センターの前身である国立武蔵療養所神経センターの田平武博士の研究チームですが*1,2、米国で多数のペプチドライブラリーのスクリーニングによりPLP139-151のEAE誘導能が発見されたのに対して*3、田平研では酵素分解で得られた蛋白断片を使ってPLP136-150がEAEを誘導することを報告しました*4。両者はほとんど同じ配列のように見えましたが、PLP136-150で誘導したEAEはまったく再発しないことが我々の研究室で確認され、その理由は不明確なままに時間が過ぎていきました。マウスの違いや誘導条件の違いではなく、ペプチド配列の微妙な違いに原因があるのだろうと考えられました。ただ、PLP136-150とPLP139-151はT細胞抗原受容体(TCR)およびMHC class IIには同じアミノ酸を使って結合すると推定され(図1)、片方のペプチドだけが再発性のEAEを起こすことが理解できませんでした。しかし再発性の病気を起こすペプチドと、一時的で再発しない病気を誘導するペプチドの研究は、自己免疫疾患の慢性化の理解に役立つだけでなく、ペプチドの免疫原性(免疫反応の誘導しやすさ)を理解する上でも興味深く、我々は研究を継続しました。
PLP136-150は制御性T細胞を誘導する
PLP136-150で誘導したEAEが回復したあと、もう一度PLPペプチドでEAE を誘導しようとしても決してEAEは起こりません(図3A)。しかしPLP139-151で誘導したEAEの回復期には、PLPペプチド接種によって強いEAE が誘導されました。PLP136-150で誘導されたEAEが再発しないことや、EAEの再誘導に抵抗性を示すことは、強力な免疫制御系が作用していることが示唆されました。そこで制御性T細胞(Treg)に着目して研究を進めました。PLP136-150でEAEを誘導してから、Tregを除去する作用のある抗CD25抗体を投与し、約1週間後にPLP136-150を接種したところ、今度はEAEがみごとに誘導されました(図3B)。この結果はPLP136-150で免役すると、制御性T細胞が強力に誘導されることを示唆しました。
図3 PLP136-150誘導EAE :制御性T細胞を除くと二度目のEAEが誘導できる
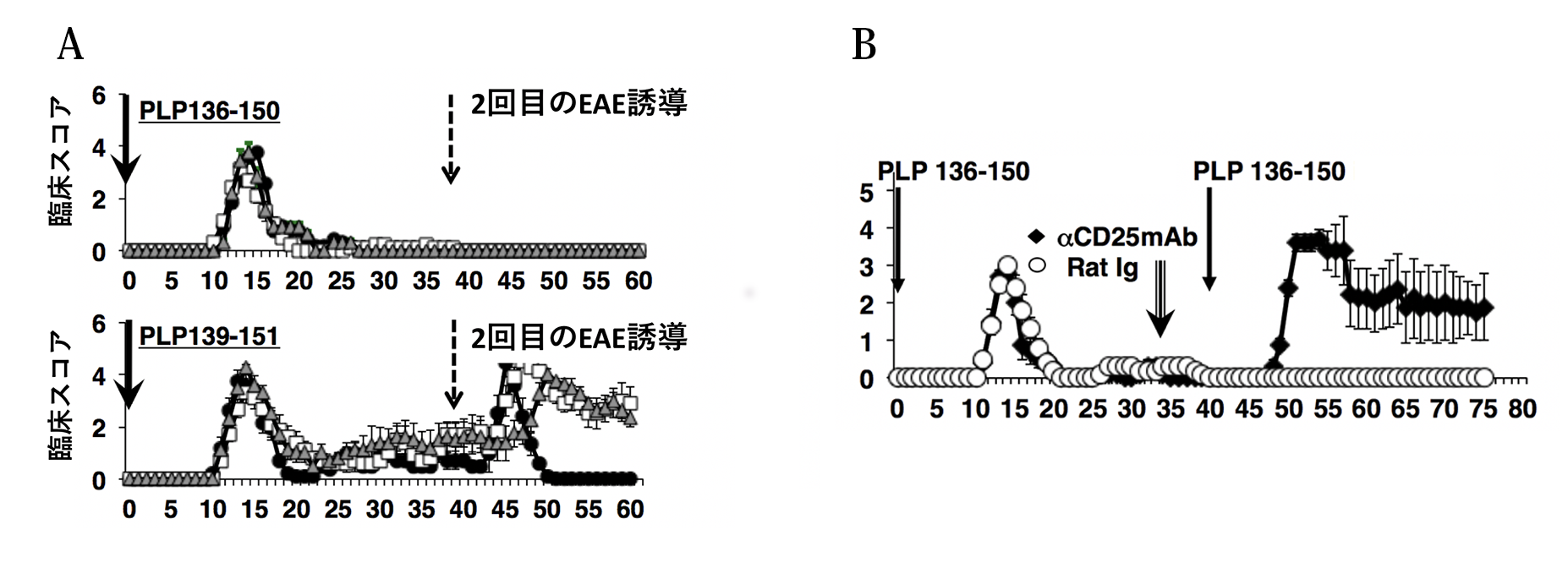
PLP136-150でEAEを誘導すると(パネルA)、2回目のEAE誘導ができなくなりますが、PLP139-151でEAEを誘導した場合には2回目のEAE 誘導で強い病気が起こりました。その理由を探るために、制御性T細胞のマーカーであるCD25に対する抗体(anti-CD25 mAb)を投与してから、day 40 にPLP136-150で免役したところ、EAEの再誘導が可能でした。これらの結果をもとに、我々はPLP136-150にはEAEの再発やEAE の再誘導を阻む制御性T細胞を誘導する性質があると推測しました。
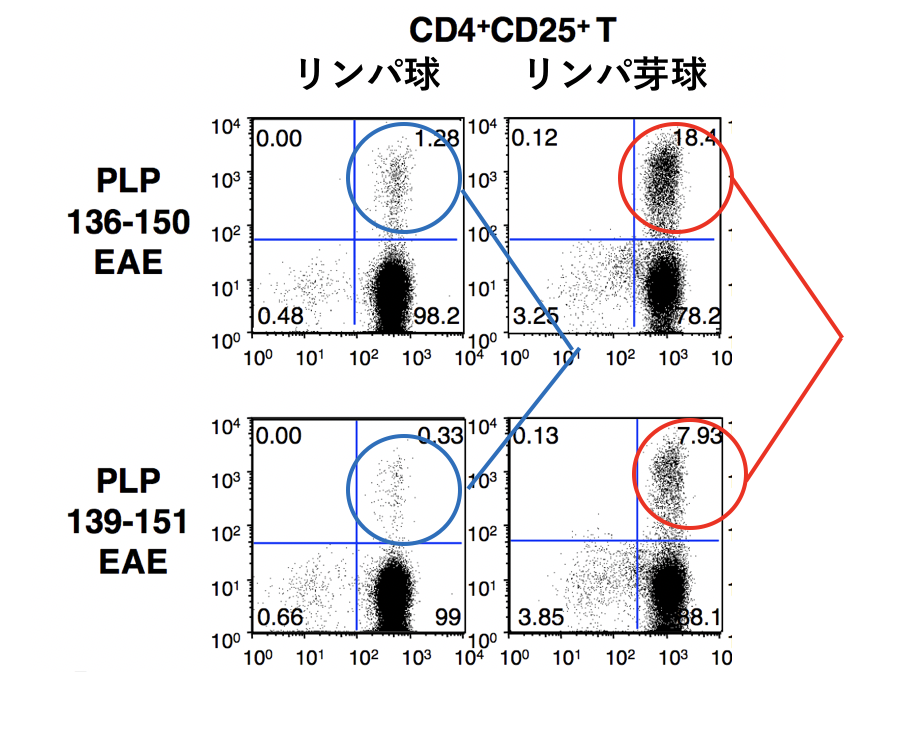
PLP136-150によってCD69とCD103を発現するTregが誘導されやすいこと、CD69+CD103+ Tregには強力なEAE 抑制活性のあることなどを確認しました。さらに我々は抗原特異的なTregを同定する技術・試薬(PLPペプチドを結合するMHC class II デキストラマー; PLP139-151/I-As dextramer)を米国の研究者(ネブラスカ大学Jay Reddy教授)に提供していただき、PLP139-151特異的T細胞の数を評価しました。PLP136-150またはPLP139-151でEAEを誘導して約1か月後にリンパ節からリンパ球やリンパ芽球を分離して解析したところ、PLP136-150でEAEを誘導した場合にCD4+CD25+ 制御性T細胞中のPLP特異的T細胞の数が有意に増加しており(図4)、PLP136-150には抗原特異的なTregを誘導する能力が強いことがわかりました。
つぎにPLP136-150とPLP139-151のペプチド量を10分の1に減量してEAEを誘導したところ、このsuboptimalな条件では、PLP136-150においてEAE 誘導能が強いことがわかりました。EAEを誘導する抗原特異的T細胞の誘導能においても、また抗原特異的Tregの誘導能においても、PLP136-150 はPLP139-151よりも優れており、抗原特異的Tregの誘導によってEAEの再発がみられなくなることが推測されました。
PLP139-151のMHC class IIへの結合は不安定である
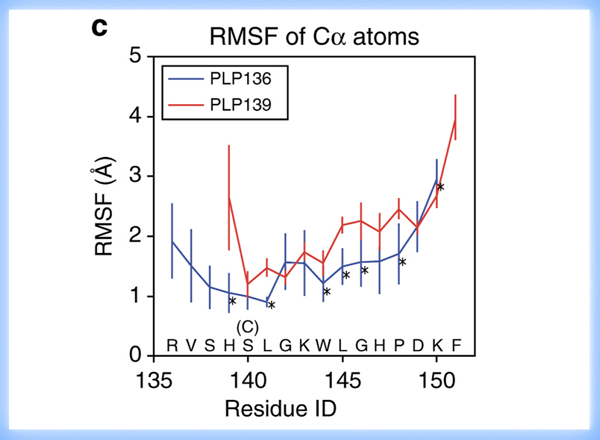
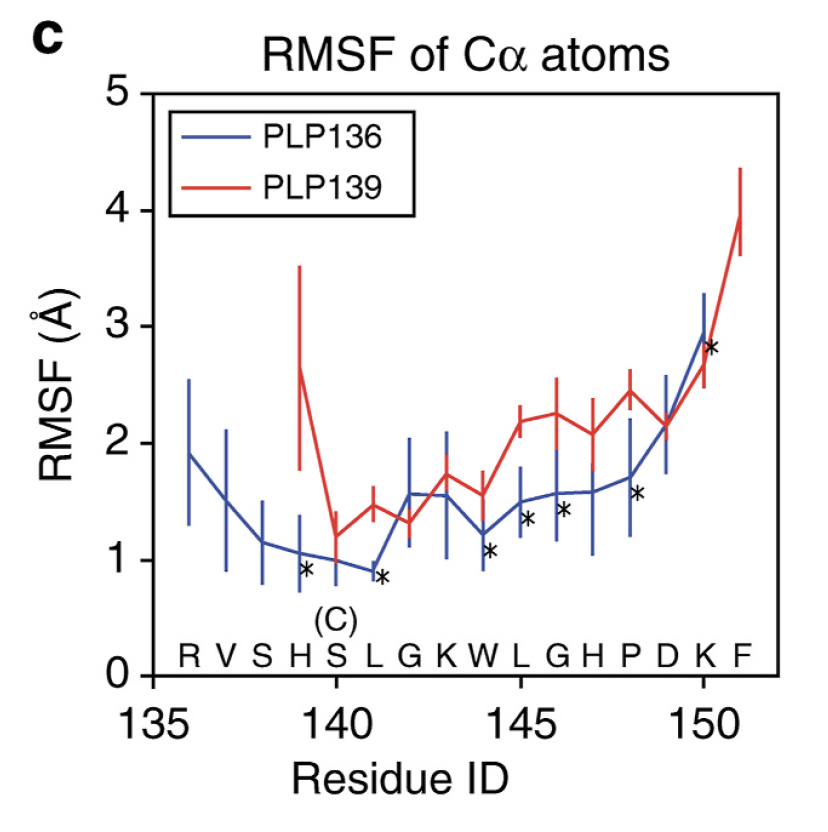
SJL/JマウスのMHC class IIであるI-As分子とPLP ペプチドの結合安定性に関する解析は櫻庭俊博士によって実施されました。分子動態とreplica exchange with solute tempering (REST)の数学的計量計算により、PLPペプチド/I-As分子複合体の溶液中における構造変化に関するシミュレーションを実施しました。解析の結果、PLP136-150ペプチドはMHC class IIの溝(MHC groove)で安定したポジションを維持しているのに対して、PLP139-151は溝からしばしば飛び出す不安定なポジションにあることがわかりました(図5)。またペプチドのN末端はMHC class IIの溝の外に飛び出した残基(flanking residues)であることが確認されました。動的構造解析によりPLP136-150がI-Asに安定して結合しているメカニズムの詳細が解明されました。
まとめと今後の展望
PLP136-150はSJLマウスのMHC class II分子であるI-Asに安定して結合することにより、免疫原性を強く発揮することがわかりました。PLP136-150でSJLマウスを感作すると、脳炎惹起性の抗原特異的T細胞も強く誘導されますが、強い活性を有するCD69+CD103+CD25high+CD4+ Tregが優先的に誘導されることにより、EAE は再発しなくなり、EAEの再誘導も困難になると考えられます。逆にMHC class IIに安定して結合できないペプチドで自己免疫病が誘導されると、病気は慢性化して難治化すると考えられます。MHC class II分子に安定して結合するペプチドを合成するには、MHC class IIの溝に結合するアミノ酸だけに配慮するのではなくて、溝の外のflanking residuesの修飾も重要であることもわかりました。
さまざまな免疫病や悪性腫瘍に対するペプチド医薬の開発において、今回の知見が活用されることが期待されます。MSを予防するワクチンに関する議論もあるなかで、我々も安全かつ有効なペプチド療法の開発に向けて研究を継続して参りたいと考えています。
用語解説
1) EAE(Experimental autoimmune encephalomyelitis:自己免疫性脳脊髄炎)
EAE はMSの動物モデルとして、病気の研究や治療法の開発に利用されています。脳や脊に存在するEAE誘導活性を持つミエリン塩基性蛋白やPLPなどのタンパク質またはそれらに由来するペプチドをマウスやラットに接種することによって誘導できます。接種された抗原に反応するT細胞が誘導され、それが脳内に浸潤して、EAEを発症します。今回の研究では、PLPの合成ペプチド(PLP136-150とPLP139-151)と結核菌死菌含有アジュバントの混和物を、SJL/Jマウスの皮下に接種して誘導しました。
2)制御性T細胞(regulatory T cells, Treg)
免疫反応や炎症反応を抑制する能力を持ったT細胞で、坂口志文教授によって発見されました。CD4陽性CD25陽性のT細胞で、転写因子Foxp3を発現します。その由来によって中枢性Treg(胸腺由来)と末梢性Treg(末梢リンパ組織由来)に分類されます。また特定の抗原に反応する抗原特異的Tregと抗原非特異的Tregに分かれます。
引用文献
*1 Endoh, M., T. Tabira, T. Kunishita, K. Sakai, T. Yamamura, and T. Taketomi: DM-20, a proteolipid apoprotein,is an encephalitogen of acute and relapsing autoimmune encephalomyelitis in mice. J Immunol 137:3832-3835, 1986
*2 Satoh, J., K. Sakai, M. Endoh, F. Koike, T. Kunishita, T. Namikawa, T. Yamamura, and T. Tabira: Experimental allergic encephalomyelitis mediated by murine encephalitogenic T cell lines specific for myelin proteolipid apoprotein. J Immunol 138:179-184, 1987
*3 Tuohy, V.K., Z. Lu, R.A. Sobel, R.A. Laursen, and M.B. Lees. Identification of an encephalitogenic determinant of myelin proteolipid protein for SJL mice. J Immunol 142: 1523-1527, 1989
*4 Endoh, M., T. Kunishita, J. Nihei, M. Nishizawa, and T. Tabira. Susceptibility to proteolipid
apoprotein and its encephaloitogenic determinants in mice. Int Arch Allergy Appl Immunol 92: 433-438, 1990
原著論文情報
- 論文名: Harnessing autoimmunity with dominant self-peptide: Modulating the sustainability of tissue-preferential antigen-specific Tregs by governing the binding stability via peptide flanking residues
- 著者: Lin, Y., S. Sakuraba, C. Masikamany, J. Reddy, Y. Tanaka, S. Miyake, and T. Yamamura
- 掲載誌:Journal of Autoimmunity
- URL:https://doi.org/10.1016/j.jaut.2023.103094
- DOI:10.1016/j.jaut. 2023.103094
助成金
本研究成果は、以下の事業・研究領域・研究課題によって行われました。
・日本医療研究開発機構(AMED)難治性疾患実用化研究事業
・日本学術振興会・科学研究費補助金
・国立精神・神経医療研究センター・精神・神経疾患研究開発費
お問い合わせ先
【研究に関する問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
神経研究所 免疫研究部
部長 山村 隆
E-mail: yamamura(a)ncnp.go.jp
TEL:042-341-2711
FAX:042-346-1753
【報道に関するお問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
総務課広報室
〒187-8551 東京都小平市小川東町4-1-1
E-mail: ncnp-kouhou(a)ncnp.go.jp
TEL:042-341-2711(代表)
FAX:042-344-6745
※E-mailは上記アドレス(a)の部分を@に変えた上でご使用ください。