
低酸素状態が末梢神経損傷後の再生を促進するメカニズムを解明
国立精神・神経医療研究センター(NCNP)神経研究所疾病研究第五部の荒木敏之部長・若月修二室長・氏家悠佳研究員、九州大学の大川恭行教授・原田哲仁教授、早稲田大学の合田亘人教授らの研究グループは、酸素が少ない状態(低酸素環境)が末梢神経損傷後の回復を早めることを初めて示しました。
モデル動物(マウス)のシュワン細胞において低酸素誘導因子1α(hypoxia inducible factor1α; HIF1α)の機能を強めることによって神経突起周囲に髄鞘という絶縁構造の形成(髄鞘化)が促進され神経が再生されることを明らかにしました。神経とともに組織の損傷が起こると血管が傷つくため、組織には酸素がいきわたりにくくなることが考えられますが、今回の結果は、その状況が神経再生を促進していることを示すものです。
本研究成果は2025年7月25日に「Journal of Biological Chemistry」オンライン版に掲載されました。
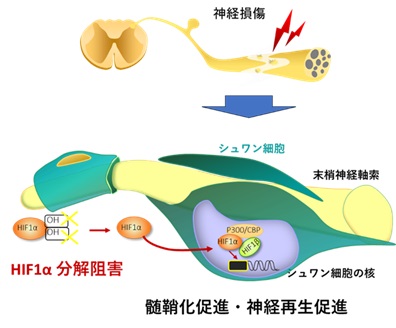
<模式図>末梢神経損傷後の再生過程におけるHIF1αの働き
研究の背景・経緯
神経細胞は単独では効率的な情報伝達を行うことができず、長い突起を介した素早いシグナル伝搬のためには神経突起の周囲が髄鞘(ミエリン)と呼ばれる構造物により取り巻かれることが必要です。
髄鞘は、中枢神経系(脳・脊髄)では稀突起膠細胞(オリゴデンドロサイト)、末梢神経ではシュワン細胞と呼ばれる細胞によって形成され、いずれの場合もそれぞれの細胞の細胞膜が幾重にも重なってぐるぐる巻きついたものが髄鞘です。細胞膜は脂質によって形成されていることから髄鞘は絶縁体として機能し、神経突起は絶縁体によって取り巻かれることによって「跳躍伝導」と呼ばれる速い電気シグナルの伝達が可能となります。この髄鞘は、主に生後発達の過程において、個体を取り巻く多様な環境の影響を受けながら形成が進み、神経伝導の効率化を通じて、運動制御や感覚機能の発達に寄与すると考えられています。
中枢神経系の発達過程において、「低酸素状態」がオリゴデンドロサイトによる髄鞘化の発達を促進する作用をもっていることが過去の論文で報告されています (Cell, 158 (2014), pp. 383-396)。ここでいう「低酸素状態」というのは病気や事故などによって引き起こされるような著しい酸素不足ではなく、通常の酸素環境・定型的な発達の中で起こる組織中の酸素濃度の変動によっておこるものです。一方、末梢神経系では、このような生理的に起こる酸素濃度変動の影響は知られていませんでした。
本研究の内容
研究グループは主に以下の4つのことを明らかにしました。
1.低酸素環境下ではHIF1αが増え髄鞘が作られやすくなる
HIF1αは、低酸素状態になると存在量が増えて機能できるようになります。我々は、マウスの後根神経節を使って作成した細胞培養に神経軸索の髄鞘化を観察する実験システムを用いて、低酸素環境下、もしくはHIF1αの分解を阻害する薬剤を投与した場合にはシュワン細胞においてHIF1αが増え、髄鞘化の促進がみられることを示しました(図1)。
2.HIF1αが少ないと神経の回復が遅れることが判明
HIF1αの生体内での役割を調べたところ、神経傷害後の再生においては、HIF1αを欠損するマウスでは再生が少し遅れて進行することがわかりました。そこで、マウスの末梢神経傷害モデルに対して、HIF1αの分解を阻害する薬物を投与すると、傷害からの回復が促進されました(図2)。
3.HIF1αが髄鞘作りに必要な遺伝子の働きをコントロール
HIF1αがシュワン細胞でどのような遺伝子の転写を制御することによって髄鞘形成を制御しているのかを検討したところ、予想されたように、Myelin basic protein(MBP)やEgr2など髄鞘化に必須とされる遺伝子をはじめとする髄鞘化との関連が報告されている複数の遺伝子の制御を行っていることが確認できました。
4.低酸素状態ではHIF1αが神経の再生を助けている
これらの結果から、HIF1αはシュワン細胞において低酸素に応答して髄鞘化関連遺伝子の発現制御を行うことにより、特に神経再生の局面において、髄鞘化促進的に作用していることが明らかとなりました。
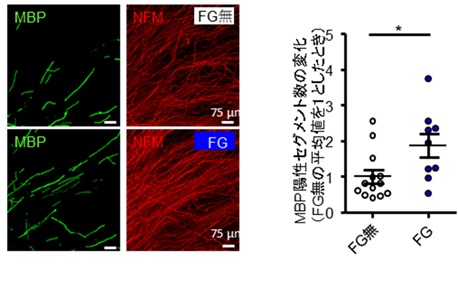
| 図1:HIF1αによる髄鞘化促進効果 マウスの後根神経節(感覚神経細胞とシュワン細胞からなる末梢神経節)を使って作成した細胞培養において神経突起(Neurofilament Mで染色されているオレンジ色の線状の構造)の周囲に形成される髄鞘(Myelin basic proteinで染色されている緑色のセグメント様構造)の数が、HIF1αの分解阻害剤(FG)の投与により増加した。 |
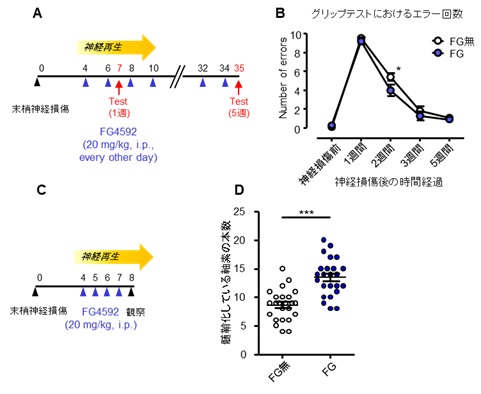
| 図2:マウスの末梢神経損傷モデルに対するHIF1分解阻害剤の再生促進 効果 A・B:マウスの坐骨神経損傷モデルを作成し、損傷4日後から34日後までHIF1α分解阻害剤FG4592を隔日投与した結果、損傷後2週以降の末梢神経機能の回復の促進がみられた。 C・D:マウスの坐骨神経損傷モデルを作成し、損傷4日後から7日後まで毎日HIF1α分解阻害剤FG4592を投与した結果、損傷後8日の末梢神経組織中の髄鞘化軸索の本数が増加しているのが観察された。 |
今後の展望
今回の研究において、神経組織中の比較的小さな酸素濃度の変動が、HIF1αの機能を介して神経系の再生に重要な影響を与える可能性を示しました。このような仕組みは、神経損傷時の環境下で神経再生を進めるために生体が獲得したメカニズムなのかもしれません。今後、このメカニズムを神経再生促進に応用するためには、今後さらにさまざまな検討が必要です。
原論文情報
論文名:Hypoxia-Inducible Factor 1α in Schwann cells promotes peripheral nerve myelination
著 者:Yuka Kobayashi-Ujiie, Shuji Wakatsuki, Yurika Numata―Uematsu, Megumi Shibata, Akihito Harada, Yasuyuki Ohkawa, Nobuhito Goda, Toshiyuki Araki
掲載誌:Journal of Biological Chemistry
DOI:10.1016/j.jbc.2025.110433
URL:https://doi.org/10.1016/j.jbc.2025.110433
参考リンク




