
神経変性疾患の末梢血ではエオメス陽性の神経細胞障害性T細胞が増加している
~バイオマーカーおよび免疫治療の標的としての意義~
神経変性疾患のほとんどは原因不明で根治療法はありません。近年免疫系が神経変性の進行に関わる可能性も議論されていますが、まだ断片的な報告があるのみで詳細は明らかになっていません。
国立精神・神経医療研究センター(NCNP)の山村隆特任研究部長を中心とする研究チームは、神経細胞を障害し炎症を誘導するリンパ球エオメス陽性ヘルパーT細胞を2015年に発見してから (Raveney et al. Nature Comm 2015)、同細胞と神経変性の関係を研究してきました。このたび、神経変性疾患である筋萎縮性側索硬化症(ALS)とアルツハイマー病(AD)患者の血液でエオメス陽性ヘルパーT細胞が増加・活性化し、神経細胞を障害するグランザイムBを分泌していることを明らかにしました。また、エオメス陽性ヘルパーT細胞は、主にケモカイン受容体CCR5とCX3CR1を発現していることから、中枢神経炎症病巣へ移行する性質を有していると考えられました。ALSでは発症から5年以内の症例でエオメス陽性ヘルパーT細胞が増加し、ADでは認知機能の低下に伴って増加する傾向を認めました。これらの結果より、神経細胞障害活性を持つエオメス陽性ヘルパーT細胞がALSやADの病態増悪において重要な役割を果たすことが示唆され、病勢を評価するバイオマーカーとしての活用や、同細胞を標的とする治療の開発に向けた取り組みが期待されます。
この研究成果は、2024年3月22日午後8時(日本時間)、脳神経内科専門誌Annals of Neurologyオンライン版に掲載されました。
国立精神・神経医療研究センター(NCNP)の山村隆特任研究部長を中心とする研究チームは、神経細胞を障害し炎症を誘導するリンパ球エオメス陽性ヘルパーT細胞を2015年に発見してから (Raveney et al. Nature Comm 2015)、同細胞と神経変性の関係を研究してきました。このたび、神経変性疾患である筋萎縮性側索硬化症(ALS)とアルツハイマー病(AD)患者の血液でエオメス陽性ヘルパーT細胞が増加・活性化し、神経細胞を障害するグランザイムBを分泌していることを明らかにしました。また、エオメス陽性ヘルパーT細胞は、主にケモカイン受容体CCR5とCX3CR1を発現していることから、中枢神経炎症病巣へ移行する性質を有していると考えられました。ALSでは発症から5年以内の症例でエオメス陽性ヘルパーT細胞が増加し、ADでは認知機能の低下に伴って増加する傾向を認めました。これらの結果より、神経細胞障害活性を持つエオメス陽性ヘルパーT細胞がALSやADの病態増悪において重要な役割を果たすことが示唆され、病勢を評価するバイオマーカーとしての活用や、同細胞を標的とする治療の開発に向けた取り組みが期待されます。
この研究成果は、2024年3月22日午後8時(日本時間)、脳神経内科専門誌Annals of Neurologyオンライン版に掲載されました。
研究の背景
NCNP免疫研究部では多発性硬化症 (MS)の実験的自己免疫性脳脊髄炎(EAE)モデルマウスを用いて、エオメス陽性ヘルパーT細胞が神経系の慢性炎症を誘導することを2015年に報告しました。さらに、MSの発症から数年―10年を経過して慢性進行期に入った患者(secondary progressive MS: SPMS) の末梢血や脳脊髄液において、同細胞が有意に増加していることを報告しました。SPMSで増加しているエオメス陽性ヘルパーT細胞は、CD4陽性T細胞であるにもかかわらず、細胞障害因子であるグランザイムBを分泌しました。グランザイムBは神経細胞のタンパク質成分の分解を引き起こすので、エオメス陽性ヘルパーT細胞が重要な病原性細胞である可能性が強く示唆されました。
神経変性疾患は、脳や脊髄の神経細胞が徐々に失われることにより様々な症状が出現する原因不明の病気で、その多くが難病であり新しい治療が求められています。その代表は、最も患者数が多く認知症を引き起こすAD、そして比較的急速に全身の筋力が低下し3~5年以内に致死的な呼吸障害に至るALSです。これまでは主に神経細胞の内外に蓄積する異常タンパク質に着目した研究が進められてきましたが、近年,神経変性疾患の進行に免疫系の細胞が関与することが明らかになり、免疫系にも目が向けられ始めているところです。ただ、現時点では神経変性疾患におけるT細胞の役割について定まった知見は得られていません。
自己免疫疾患であるMSは再発・寛解型で発症し、その一部が二次進行型(SPMS)へ移行します。MSと神経変性疾患の関連は明らかにされていませんが、SPMSは進行が遅く脳内慢性炎症による脳萎縮を来たし、治療に抵抗性である点から、SPMSは神経変性疾患ではないかという議論もあります。このような背景から、SPMSで増加しているエオメス細胞ヘルパーT細胞について、ALSやADでも検証する意義があると考えられました。
神経変性疾患は、脳や脊髄の神経細胞が徐々に失われることにより様々な症状が出現する原因不明の病気で、その多くが難病であり新しい治療が求められています。その代表は、最も患者数が多く認知症を引き起こすAD、そして比較的急速に全身の筋力が低下し3~5年以内に致死的な呼吸障害に至るALSです。これまでは主に神経細胞の内外に蓄積する異常タンパク質に着目した研究が進められてきましたが、近年,神経変性疾患の進行に免疫系の細胞が関与することが明らかになり、免疫系にも目が向けられ始めているところです。ただ、現時点では神経変性疾患におけるT細胞の役割について定まった知見は得られていません。
自己免疫疾患であるMSは再発・寛解型で発症し、その一部が二次進行型(SPMS)へ移行します。MSと神経変性疾患の関連は明らかにされていませんが、SPMSは進行が遅く脳内慢性炎症による脳萎縮を来たし、治療に抵抗性である点から、SPMSは神経変性疾患ではないかという議論もあります。このような背景から、SPMSで増加しているエオメス細胞ヘルパーT細胞について、ALSやADでも検証する意義があると考えられました。
研究の概要
SPMSと同じく慢性的に進行する神経障害を特徴とするALSとADに着目し、血液中のヘルパーT細胞中のエオメス陽性ヘルパーT細胞の割合(頻度)や性質について調べました。
はじめに、ALS患者、AD患者と、両患者群に年齢・性別をマッチさせた高齢健常者、さらに60歳未満の若年健常者を対象とし、血液中のエオメス陽性ヘルパーT細胞の頻度をフローサイトメーターで解析しました。健常者では年齢による頻度の差はありませんでしたが、患者と健常者の比較では、ALS患者、AD患者のいずれにおいても、エオメス陽性ヘルパーT細胞の頻度は高齢健常者と比べて有意に高いという結果が得られました(図1).また、ALS患者3例の脳脊髄液を採取してエオメス陽性ヘルパーT細胞の頻度を測定したところ、3例とも血液中より高頻度でした。

図1 血液中ヘルパーT細胞中のエオメス陽性ヘルパーT細胞頻度
ALS患者、AD患者ともに、エオメスの発現は健常者と比べて有意に高頻度でした。
***p<0.001, **p<0.01
患者群のエオメス陽性ヘルパーT細胞の多くはエフェクターメモリーT細胞の特徴を示しました。エフェクターメモリーT細胞は、いったん抗原に出会って活性化した後、再度の抗原との戦いに備えて体内を循環している細胞であり、患者血液中のエオメス陽性ヘルパーT細胞もそのような性質を持つものと推測されます。また,同細胞の多くはケモカイン受容体CCR5とCX3CR1を発現していました。これらの受容体はT細胞が炎症を起こしている場所に移動していく際に働くことから、血液中のエオメス陽性ヘルパーT細胞は中枢神経に移動する特性を持つと考えられました。
次に、上記のケモカイン受容体を両方とも発現している細胞をセルソーターで集めました。この細胞集団はエオメス陽性ヘルパーT細胞を多く含んでおり,刺激するとグランザイムBを分泌する際にみられる脱顆粒マーカーのCD107aを発現しました。また,AD・ALS患者の血液中エオメス陽性ヘルパーT細胞はGranzyme Bを強く発現していました(図2A)。さらに、血液中ヘルパーT細胞を集めて刺激し、グランザイムBを分泌する程度をELISpot法で測定したところ、健常者と比べて患者のヘルパーT細胞はグランザイムBを有意に多く分泌しました(図2B)。

図2
A: 血液中ヘルパーT細胞のグランザイムB発現頻度
グランザイムBを発現するヘルパーT細胞の頻度は、ALSおよびAD患者で有意に増加
していました。
B: 血液中ヘルパーT細胞のグランザイムB分泌スポット数(ELISpot法)
患者群のヘルパーT細胞は、健常者より多くのグランザイムBを分泌しました。
***p<0.001, **p<0.01, *p<0.05
最後に、エオメス陽性ヘルパーT細胞の頻度と臨床情報との関連性について検討したところ,ALSでは同細胞の頻度が高かった症例はいずれも発症から5年以内の,まだ呼吸状態の致命的な低下のない(侵襲的人工呼吸を必要としない)症例に限られていました(図3A)。一方ADでは、認知症の重症度を調べるテストである改訂長谷川式簡易知能機能スケールの点数(30満点、重症ほど低スコア)が低いほど有意にエオメス陽性ヘルパーT細胞の頻度が高く、重症例では同細胞の頻度が高いという結果が得られました(図3B)。
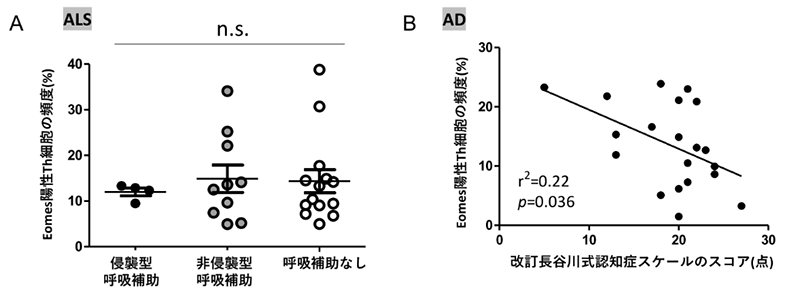
図3
A: ALS患者における、呼吸状態別のエオメス陽性ヘルパーT細胞の頻度
呼吸状態による有意な差はありませんでしたが、高頻度であった症例はいずれもまだ侵襲型
呼吸補助を必要としない比較的初期の患者でした。
B: AD患者における、認知症スケールとエオメス陽性ヘルパーT細胞頻度の相関関係
認知症スケールのスコアが低い重症の患者ほどエオメス陽性ヘルパーT細胞の頻度が高いと
いう結果でした。
当研究部の研究成果ですが、ADおよびALSのモデルマウスで、脳内エオメス陽性ヘルパーT細胞の集積が確認されています。さらに同細胞は、神経変性に伴う神経細胞障害によって放出されるORF1というタンパク抗原に反応して活性化し、グランザイムBを放出することがわかりました(Takahashi et al. iScience, 2023)。このマウスの結果を踏まえて、ヒトの神経変性疾患患者においてもORF1がエオメス陽性ヘルパーT細胞の抗原となっている可能性は、これからの研究課題と考えられます。
以上をまとめると、エオメス陽性ヘルパーT細胞がSPMSと同様にADやALSの血液中でも増加しており、グランザイムBを介して細胞を障害する特性を有することが明らかになりました。また、ALS、ADのいずれにおいても、エオメス陽性ヘルパーT細胞は症状の進行していく時期に高頻度になるものと考えられ、同細胞は病態進行のバイオマーカーになりうることが示唆されました。
はじめに、ALS患者、AD患者と、両患者群に年齢・性別をマッチさせた高齢健常者、さらに60歳未満の若年健常者を対象とし、血液中のエオメス陽性ヘルパーT細胞の頻度をフローサイトメーターで解析しました。健常者では年齢による頻度の差はありませんでしたが、患者と健常者の比較では、ALS患者、AD患者のいずれにおいても、エオメス陽性ヘルパーT細胞の頻度は高齢健常者と比べて有意に高いという結果が得られました(図1).また、ALS患者3例の脳脊髄液を採取してエオメス陽性ヘルパーT細胞の頻度を測定したところ、3例とも血液中より高頻度でした。

図1 血液中ヘルパーT細胞中のエオメス陽性ヘルパーT細胞頻度
ALS患者、AD患者ともに、エオメスの発現は健常者と比べて有意に高頻度でした。
***p<0.001, **p<0.01
患者群のエオメス陽性ヘルパーT細胞の多くはエフェクターメモリーT細胞の特徴を示しました。エフェクターメモリーT細胞は、いったん抗原に出会って活性化した後、再度の抗原との戦いに備えて体内を循環している細胞であり、患者血液中のエオメス陽性ヘルパーT細胞もそのような性質を持つものと推測されます。また,同細胞の多くはケモカイン受容体CCR5とCX3CR1を発現していました。これらの受容体はT細胞が炎症を起こしている場所に移動していく際に働くことから、血液中のエオメス陽性ヘルパーT細胞は中枢神経に移動する特性を持つと考えられました。
次に、上記のケモカイン受容体を両方とも発現している細胞をセルソーターで集めました。この細胞集団はエオメス陽性ヘルパーT細胞を多く含んでおり,刺激するとグランザイムBを分泌する際にみられる脱顆粒マーカーのCD107aを発現しました。また,AD・ALS患者の血液中エオメス陽性ヘルパーT細胞はGranzyme Bを強く発現していました(図2A)。さらに、血液中ヘルパーT細胞を集めて刺激し、グランザイムBを分泌する程度をELISpot法で測定したところ、健常者と比べて患者のヘルパーT細胞はグランザイムBを有意に多く分泌しました(図2B)。

図2
A: 血液中ヘルパーT細胞のグランザイムB発現頻度
グランザイムBを発現するヘルパーT細胞の頻度は、ALSおよびAD患者で有意に増加
していました。
B: 血液中ヘルパーT細胞のグランザイムB分泌スポット数(ELISpot法)
患者群のヘルパーT細胞は、健常者より多くのグランザイムBを分泌しました。
***p<0.001, **p<0.01, *p<0.05
最後に、エオメス陽性ヘルパーT細胞の頻度と臨床情報との関連性について検討したところ,ALSでは同細胞の頻度が高かった症例はいずれも発症から5年以内の,まだ呼吸状態の致命的な低下のない(侵襲的人工呼吸を必要としない)症例に限られていました(図3A)。一方ADでは、認知症の重症度を調べるテストである改訂長谷川式簡易知能機能スケールの点数(30満点、重症ほど低スコア)が低いほど有意にエオメス陽性ヘルパーT細胞の頻度が高く、重症例では同細胞の頻度が高いという結果が得られました(図3B)。

図3
A: ALS患者における、呼吸状態別のエオメス陽性ヘルパーT細胞の頻度
呼吸状態による有意な差はありませんでしたが、高頻度であった症例はいずれもまだ侵襲型
呼吸補助を必要としない比較的初期の患者でした。
B: AD患者における、認知症スケールとエオメス陽性ヘルパーT細胞頻度の相関関係
認知症スケールのスコアが低い重症の患者ほどエオメス陽性ヘルパーT細胞の頻度が高いと
いう結果でした。
当研究部の研究成果ですが、ADおよびALSのモデルマウスで、脳内エオメス陽性ヘルパーT細胞の集積が確認されています。さらに同細胞は、神経変性に伴う神経細胞障害によって放出されるORF1というタンパク抗原に反応して活性化し、グランザイムBを放出することがわかりました(Takahashi et al. iScience, 2023)。このマウスの結果を踏まえて、ヒトの神経変性疾患患者においてもORF1がエオメス陽性ヘルパーT細胞の抗原となっている可能性は、これからの研究課題と考えられます。
以上をまとめると、エオメス陽性ヘルパーT細胞がSPMSと同様にADやALSの血液中でも増加しており、グランザイムBを介して細胞を障害する特性を有することが明らかになりました。また、ALS、ADのいずれにおいても、エオメス陽性ヘルパーT細胞は症状の進行していく時期に高頻度になるものと考えられ、同細胞は病態進行のバイオマーカーになりうることが示唆されました。
今後の展望
今回の研究結果から、エオメス陽性ヘルパーT細胞がSPMSのみならず神経変性疾患の病態にも関与しており、神経変性疾患のバイオマーカーとして利用できる可能性が示唆されました。今後は同細胞の機能についてより詳しく調べるほか、AD・ALS以外の神経変性疾患患者における検討を行うことで、神経変性疾患の病態解明や早期診断、新たな治療法の開発に近づくことが期待されます。
用語説明
1) 多発性硬化症(multiple sclerosis: MS)
脳、脊髄、視神経の様々な場所に炎症を起こす自己免疫疾患で、若年で発症することが多い。発症して数年−10年は再発と寛解を繰り返す再発寛解型(relapsing-remitting MS: RRMS)の形をとることが多いが、再発を繰り返すうちに徐々に進行性の経過を辿る場合がある。これが二次進行型多発性硬化症(secondary progressive MS: SPMS)で、血液中のエオメス陽性Th細胞が増加しているのは、SPMSに特徴的である。
2) アルツハイマー病
アルツハイマー病 (Alzheimer’s disease: AD) は認知症を来す神経変性疾患の一種で、65歳以上の高齢者に好発する。病理学的には、大脳皮質の神経細胞内に蓄積した異常リン酸化タウ蛋白により形成される神経原線維変化と、細胞外へのアミロイドβ蛋白の蓄積 (老人斑) の2点を特徴とし、記憶・言語・空間認知・遂行機能の障害を来す。
3) 筋萎縮性側索硬化症
筋萎縮性側索硬化症(amyotrophic lateral sclerosis: ALS)は脳や脊髄の運動神経に細胞内封入体が形成され,神経細胞の脱落により手足・咽頭・呼吸筋などの筋力低下を起こす疾患。神経変性疾患としては比較的急速に進行し,発症から3~5年で呼吸不全に至る例が多い.ADと同様に、症状改善に有効な治療法は確立されていない。
4) Eomes (Eomesodermin) 陽性ヘルパーT細胞(=エオメス陽性ヘルパーT細胞)
T細胞は免疫の司令塔で、成熟するとCD8陽性キラーT細胞とCD4陽性ヘルパーT細胞に分かれる。一般的に、キラーT細胞はグランザイムBなどの細胞障害性物質を介してウイルスに感染した細胞などを攻撃し、ヘルパーT細胞は様々なサイトカイン(細胞間連絡物質)を分泌して、免疫の働きを調節する役割を持つ。EomesはキラーT細胞で強く発現する転写因子で、細胞障害性物質の発現に関わるが、この研究で着目した細胞は、CD4陽性ヘルパーT細胞でありながらEomesを強く発現し、キラーT細胞に似た特徴を示す。
脳、脊髄、視神経の様々な場所に炎症を起こす自己免疫疾患で、若年で発症することが多い。発症して数年−10年は再発と寛解を繰り返す再発寛解型(relapsing-remitting MS: RRMS)の形をとることが多いが、再発を繰り返すうちに徐々に進行性の経過を辿る場合がある。これが二次進行型多発性硬化症(secondary progressive MS: SPMS)で、血液中のエオメス陽性Th細胞が増加しているのは、SPMSに特徴的である。
2) アルツハイマー病
アルツハイマー病 (Alzheimer’s disease: AD) は認知症を来す神経変性疾患の一種で、65歳以上の高齢者に好発する。病理学的には、大脳皮質の神経細胞内に蓄積した異常リン酸化タウ蛋白により形成される神経原線維変化と、細胞外へのアミロイドβ蛋白の蓄積 (老人斑) の2点を特徴とし、記憶・言語・空間認知・遂行機能の障害を来す。
3) 筋萎縮性側索硬化症
筋萎縮性側索硬化症(amyotrophic lateral sclerosis: ALS)は脳や脊髄の運動神経に細胞内封入体が形成され,神経細胞の脱落により手足・咽頭・呼吸筋などの筋力低下を起こす疾患。神経変性疾患としては比較的急速に進行し,発症から3~5年で呼吸不全に至る例が多い.ADと同様に、症状改善に有効な治療法は確立されていない。
4) Eomes (Eomesodermin) 陽性ヘルパーT細胞(=エオメス陽性ヘルパーT細胞)
T細胞は免疫の司令塔で、成熟するとCD8陽性キラーT細胞とCD4陽性ヘルパーT細胞に分かれる。一般的に、キラーT細胞はグランザイムBなどの細胞障害性物質を介してウイルスに感染した細胞などを攻撃し、ヘルパーT細胞は様々なサイトカイン(細胞間連絡物質)を分泌して、免疫の働きを調節する役割を持つ。EomesはキラーT細胞で強く発現する転写因子で、細胞障害性物質の発現に関わるが、この研究で着目した細胞は、CD4陽性ヘルパーT細胞でありながらEomesを強く発現し、キラーT細胞に似た特徴を示す。
原著論文情報
・タイトル
Pathogenic potential of Eomesodermin-expressing T-helper cells in neurodegenerative diseases
・著者名
Tomomi Kanazawa, Wakiro Sato, Ben J.E. Raveney, Daiki Takewaki, Atsuko Kimura, Hiromi Yamaguchi, Yuma Yokoi, Reiko Saika, Yuji Takahashi, Tsuneo Fujita, Shinji Saiki, Akira Tamaoka, Shinji Oki, Takashi Yamamura
著者名と所属日本語表記
金澤智美1,5,6,佐藤和貴郎1,2,Ben J.E. Raveney1, 竹脇大貴1,木村敦子1,山口広美1, 横井優磨3,雑賀玲子4,高橋祐二4,藤田恒夫5,斉木臣二6,玉岡晃6,大木伸司1,山村隆1,2
1国立精神・神経医療研究センター神経研究所 免疫研究部
2国立精神・神経医療研究センター病院 多発性硬化症センター
3国立精神・神経医療研究センター病院 精神科
4国立精神・神経医療研究センター病院 脳神経内科
5日立総合病院 神経内科
6筑波大学医学部 神経内科
・雑誌
Annals of Neurology
Pathogenic potential of Eomesodermin-expressing T-helper cells in neurodegenerative diseases
・著者名
Tomomi Kanazawa, Wakiro Sato, Ben J.E. Raveney, Daiki Takewaki, Atsuko Kimura, Hiromi Yamaguchi, Yuma Yokoi, Reiko Saika, Yuji Takahashi, Tsuneo Fujita, Shinji Saiki, Akira Tamaoka, Shinji Oki, Takashi Yamamura
著者名と所属日本語表記
金澤智美1,5,6,佐藤和貴郎1,2,Ben J.E. Raveney1, 竹脇大貴1,木村敦子1,山口広美1, 横井優磨3,雑賀玲子4,高橋祐二4,藤田恒夫5,斉木臣二6,玉岡晃6,大木伸司1,山村隆1,2
1国立精神・神経医療研究センター神経研究所 免疫研究部
2国立精神・神経医療研究センター病院 多発性硬化症センター
3国立精神・神経医療研究センター病院 精神科
4国立精神・神経医療研究センター病院 脳神経内科
5日立総合病院 神経内科
6筑波大学医学部 神経内科
・雑誌
Annals of Neurology
助成金
本研究成果は、以下の事業・研究領域・研究課題によって行われました。
・日本医療研究開発機構(AMED) 難治性疾患実用化研究事業
・日本学術振興会・科学研究費補助金
・国立精神・神経医療研究センター 精神・神経疾患研究開発費
・日本多発性硬化症協会・医学研究助成
・加藤記念難病研究助成基金
・日本医療研究開発機構(AMED) 難治性疾患実用化研究事業
・日本学術振興会・科学研究費補助金
・国立精神・神経医療研究センター 精神・神経疾患研究開発費
・日本多発性硬化症協会・医学研究助成
・加藤記念難病研究助成基金
関連リンク
プレスリリース(2023/03/22)免疫介在性神経障害におけるミクログリアの役割 〜ミクログリアサブセットとエオメス陽性ヘルパーT細胞の関係〜
https://www.ncnp.go.jp/topics/2023/20230322p.html
プレスリリース(2022/04/26)免疫細胞が引き起こす新しい神経細胞障害メカニズムの発見 〜神経変性疾患に共通した病態の伝播・拡散機序〜
https://www.ncnp.go.jp/topics/2022/20220426p.html
プレスリリース(2021/03/09)二次進行型多発性硬化症の診療に有用な免疫学的バイオマーカーを確立: 〜エオメス陽性ヘルパーT細胞の研究に基づく成果〜
https://www.ncnp.go.jp/topics/2021/20210309p.html
神経研究所
https://www.ncnp.go.jp/neuroscience/index.php
https://www.ncnp.go.jp/topics/2023/20230322p.html
プレスリリース(2022/04/26)免疫細胞が引き起こす新しい神経細胞障害メカニズムの発見 〜神経変性疾患に共通した病態の伝播・拡散機序〜
https://www.ncnp.go.jp/topics/2022/20220426p.html
プレスリリース(2021/03/09)二次進行型多発性硬化症の診療に有用な免疫学的バイオマーカーを確立: 〜エオメス陽性ヘルパーT細胞の研究に基づく成果〜
https://www.ncnp.go.jp/topics/2021/20210309p.html
神経研究所
https://www.ncnp.go.jp/neuroscience/index.php




