2023年3月22日
国立研究開発法人国立精神・神経医療研究センター(NCNP)
印刷用PDF(600KB)
免疫介在性神経障害におけるミクログリアの役割
〜ミクログリアサブセットとエオメス陽性ヘルパーT細胞の関係〜
国立精神・神経医療研究センター(NCNP)神経研究所免疫研究部の張晨陽研究員、山村隆部長、大木伸司室長らの研究グループは、神経変性病態に関連して出現する2種類のミクログリア亜集団が、免疫細胞(エオメス陽性ヘルパーT細胞)による神経細胞障害に重要な役割を果たすことを明らかにしました。再発寛解型多発性硬化症(relapsing-remitting multiple sclerosis: RRMS)で発症するMS患者の一部は、慢性炎症と神経変性を伴う二次進行型多発性硬化症(secondary progressive multiple sclerosis: SPMS)へ移行します。研究グループは独自にSPMSのマウスモデルを確立し、T細胞の一種であるEome陽性Th細胞(エオメス陽性ヘルパーT細胞)が病原性細胞であることを発見し(Raveney et al. Nature Comm 2015)、SPMS患者試料の解析でも確証を得ていました(Raveney et al. PNAS 2021)。しかし、エオメス陽性ヘルパーT細胞が脳内でどのように活性化し、神経細胞障害を引き起こすのか、詳細は不明でした。近年のシングルセルRNA-Seq解析技術の進歩に伴って、神経変性病態に関連したミクログリアサブセットとしてDisease-associated microglia(DAM)が注目されていますが、脳内には他にも多様な性質を持つミクログリア亜集団が不均一に分布します。ミクログリアは脳内の免疫細胞とも呼ばれ、抗原提示細胞としてT細胞の活性化を引き起こす機能を持つことは示されていましたが、炎症誘導に関連するミクログリアが神経細胞死を引き起こす機序の詳細は不明でした。
今回の研究で、特定のミクログリア集団がEomes陽性Th細胞の分化誘導や活性化に直接関与することがわかりました。またミクログリアが提示する抗原の同定にも成功し、一連の研究成果は神経変性疾患の治療法開発に大きく貢献することが期待できます。
この研究成果は、2023年3月10日に、Cells 誌のオンライン版に掲載されました。
研究の背景
MSは、免疫系が自身の中枢神経系を攻撃することで発症する自己免疫疾患で、そのほとんどは発症初期に再発寛解型多発性硬化症(RRMS)と診断されます。RRMSでは再発期の脳内急性炎症が特徴的ですが、一般には回復しやすい病態です。しかし病歴が長くなると、その一部は神経変性を伴う二次進行型多発性硬化症(SPMS)に移行します。SPMSでは脱髄に加えて神経細胞の不可逆的な変性が起こり、脳萎縮やそれに伴う歩行困難、認知機能障害など、進行性で重篤な中枢神経症状を呈します。SPMSに有効な薬剤は限られ、薬効を説明しうる分子機序の詳細も明らかでありません。研究チームが発見したエオメス陽性ヘルパーT細胞はSPMSや筋萎縮性側索硬化症の神経変性過程を促進しますが、この細胞が神経細胞死を引き起こすためには、何らかの抗原提示細胞によって提示された抗原に反応して活性化し細胞障害性分子グランザイムBを放出することが必須です。長い期間に及ぶ慢性神経変性の病態では、樹状細胞やマクロファージなどの比較的寿命が短い免疫系の抗原提示細胞に代わって、脳内の免疫細胞であるミクログリアが抗原提示に関わることが予想されましたが、その詳細は不明でした。
研究の概要
本研究グループは、以前に独自に開発したSPMSマウスモデルを用いて、エオメス陽性ヘルパーT細胞がSPMSの病原性細胞であることを報告しました(Raveney et al. Nat Comm 2015, Raveney et al. PNAS 2021ほか)。今回の研究では、エオメス陽性ヘルパーT細胞と脳内ミクログリアとの機能的な関係を明らかにすることで、脳内でエオメス陽性ヘルパーT細胞が生成し、神経細胞障害を引き起こす過程を解明することを目的としました。
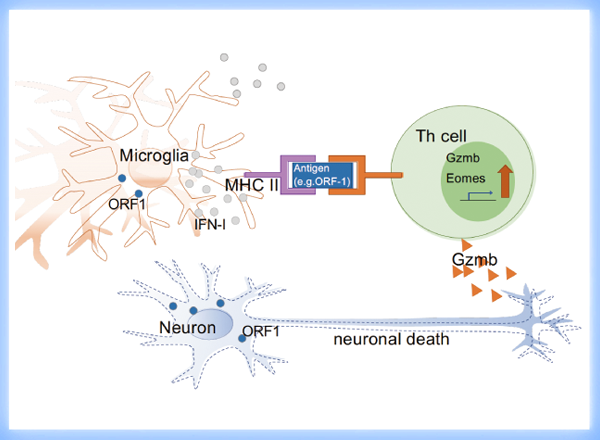
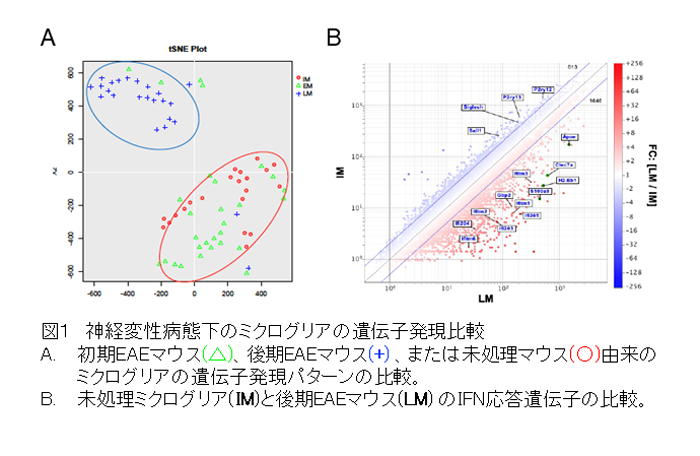
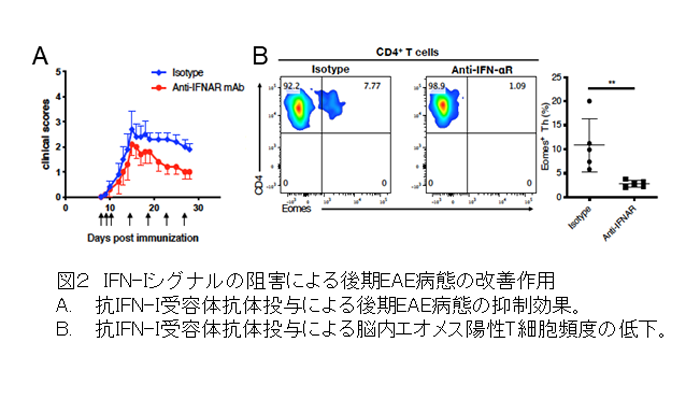
研究チームはまず、独自に開発したSPMSのマウスモデル(Raveney et al. Nat Comm 2015)では、ミクログリアの活性化を抑えるミノサイクリンの投与によって、麻痺症状が改善し、エオメス陽性ヘルパーT細胞も減少することを示しました。つぎにシングルセルRNA-Seq解析で様々なミクログリア亜集団を同定し、その中で免疫応答の制御に関わる表現型を示す2種類の細胞集団に着目しました。すなわちSPMSのモデルマウスでは、I型インターフェロン(IFN-I)による活性化の痕跡を示すミクログリア亜集団(IFNミクログリア;図1)と、抗原提示に関わるMHCクラスIIを高発現するミクログリア亜集団(MHC IIミクログリア)が増加していました。この結果から、同マウスの脳内ではIFNミクログリアによってIFN-Iが大量に産生されていること、そして脳内の未知抗原をMHC II上に提示したMHC IIミクログリアによって、エオメス陽性ヘルパーT細胞が活性化することが予測されました。そこで、まずSPMSモデルマウスのIFN-Iシグナル伝達を抗IFN-I受容体抗体で抑えたところ、病態は顕著に改善し、エオメス陽性ヘルパーT細胞も著明に減少しました(図2)。
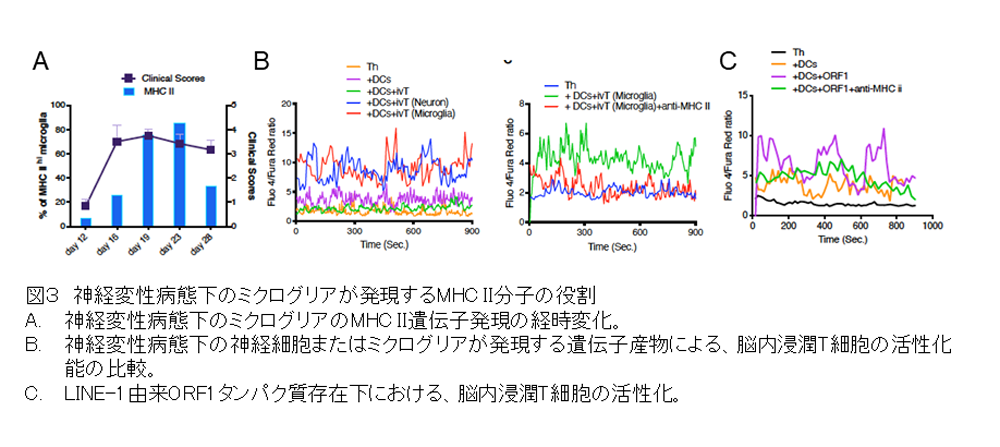
つぎにSPMSマウスの炎症部位から神経細胞やミクログリアを分離し、その細胞内にある転写産物(mRNA)がコードする多様なタンパク質・ペプチドを発現させて、同じくSPMSマウスの炎症部位から分離したエオメス陽性Th細胞が反応するかを検証しました。スクリーニングの結果、発現させた分子の中には、MHC II上に提示されてエオメス陽性ヘルパーT細胞を活性化する抗原が存在することが確認されました。これまで研究チームは、ジャンクDNAに分類され、ゲノム内を転移する因子として知られるレトロトランスポゾンLINE-1に注目してきましたが、今回LINE-1由来のORF1タンパク質が、エオメス陽性ヘルパーT細胞を活性化する抗原の一つであることも明らかにしました(図3)。
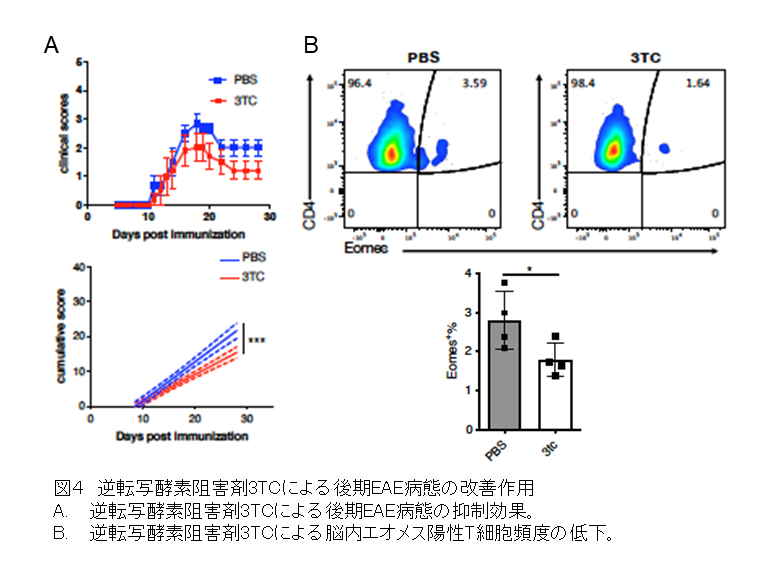
最後に研究グループは、SPMSモデルマウスに逆転写酵素阻害剤3TCを投与してLINE-1の活性化を抑制したところ、病態が有意に改善し、エオメス陽性ヘルパーT細胞も減少することを明らかにしました(図4)。一連の結果から、LINE-1の複製中間体などの異所性核酸の蓄積により、IFN-Iに満たされた脳内でエオメス陽性ヘルパーT細胞が生成し、LINE-1 ORF1タンパク質などの異所性タンパク質の抗原提示を受けて同T細胞が活性化すること、そしてその産生するグランザイムBが神経細胞死を引き起こす可能性が示され、これがSPMSにおける神経変性病態の発症メカニズムであることが明らかとなりました。
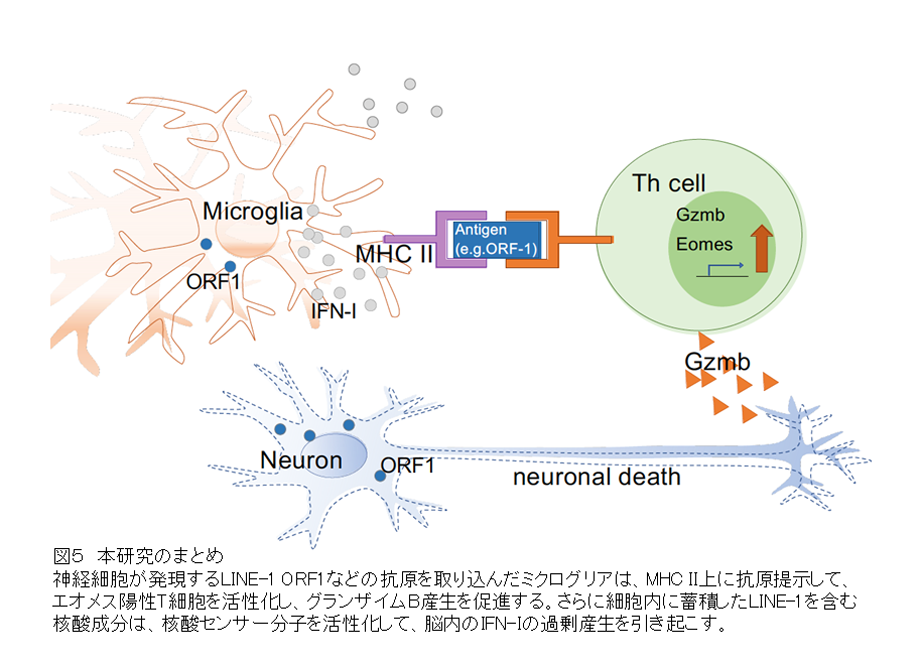
研究チームは最近、SPMSマウスモデルだけでなく、筋萎縮性側索硬化症モデルマウス(mSOD1マウス)やアルツハイマー型認知症のモデルマウス(5xFADマウス)など、より広範な神経変性疾患モデルマウスの脳内にもエオメス陽性ヘルパーT細胞が集積し、ORF1タンパク質を認識して活性化することにより、神経細胞障害因子であるグランザイムBを放出して神経細胞死を引き起こすことを報告しています(Takahashi et al. iScience 2022)。神経変性疾患患者の神経細胞では、LINE-1の異所性活性化が顕著に生じているという報告が複数あることから、今回の研究から明らかとなったミクログリアによるLINE-1抗原の提示と、引き続くエオメス陽性ヘルパーT細胞の活性化が、さまざまな神経変性疾患で極めて重要な意義を持つことが予想され、治療法開発に役立つ重要な研究成果が得られたと考えています(図5)。
今後の展望
今回の研究結果から、様々な神経変性疾患の病態形成過程において、ミクログリアによるLINE-1抗原の提示と、LINE-1抗原の認識によって引き起こされるエオメス陽性ヘルパーT細胞の活性化が重要な役割を果たすことが明らかとなりました。阻害抗体によるIFNシグナル抑制がエオメス陽性ヘルパーT細胞の生成を阻害したという今回の結果は、エオメス陽性ヘルパーT細胞の生成においてIFN-Iが重要な役割を果たすことを意味します。LINE-1由来核酸分子の過剰産生は、核酸センサー分子を活性化してIFN-I産生を引き起こすことが容易に想像されるため、今後はこれらの点を明らかにするために、IFN-Iによるエオメス陽性ヘルパーT細胞の生成機序とLINE-1の挙動の解析を進めます。近い将来、エオメス陽性ヘルパーT細胞を介した神経変性病態形成の分子機序の全容解明が進むことが期待できます。さらにLINE-1の活性化を抑制する逆転写酵素阻害剤が、有意な病態改善効果とエオメス陽性ヘルパーT細胞の抑制効果を示したことは、LINE-1阻害が、神経変性病態の新たな治療アプローチとなりうることを示しており、有効な治療法がない神経変性疾患の新しい治療戦略につながることが期待されます。
用語説明
注1)多発性硬化症(multiple sclerosis; MS)
患者数が国内では約2万5000人、全世界では200万〜300万人と推定される中枢神経系の脱髄疾患で、ほとんどはRRMS(再発寛解型MS;relapsing-remitting MS)であるが、その一部は進行性病態であるSPMS(二次進行型MS;secondary progressive MS)に移行する。SPMS では脱髄と並行して神経細胞障害による顕著な脳萎縮を認める。研究チームは、SPMSの動物モデルを独自に確立し、脳内に集積したエオメス陽性Tによる神経細胞障害が、SPMSの神経変性の実体であることを明らかにしている。
注2)ミクログリア
中枢神経系に分布するグリア細胞の一種であり、脳内の免疫担当細胞とも呼ばれる。胎生期の卵黄嚢に由来する独自の細胞系譜を持ち、シナプス刈り込みや脳内の死細胞の貪食・除去に関わるほか、細胞表面に発現するMHC II分子(後述)を介した抗原提示も行う。神経変性病態下で活性化し、炎症性の表現系を持つ様々なサブセットに分化することが、近年のシングルセルRNA Seq解析などから明らかとなってきたが、各サブセットと病態との関連は必ずしも明らかでない。
注3)主要組織適合性遺伝子複合体クラスII(Major histocompatibility complex II, MHC II)
ヒトではヒト白血球抗原遺伝子複合体(HLA)としても知られ、免疫応答の制御に中心的な役割を果たす。免疫細胞である樹状細胞をはじめとするプロフェッショナルな抗原提示細胞が発現し、食作用により取り込んだ細胞外タンパク質を、リソソーム内で消化して得られたペプチド断片を分子内の溝に配置し、主にCD4陽性のヘルパーT細胞に抗原提示する。提示されたペプチドとMHC IIの複合体と結合するT細胞受容体を発現するヘルパーT細胞は活性化し、様々なエフェクター機能を発揮する。
注4)I型インターフェロン(IFN-I)
IFN-αやIFN-βなどを含むインターフェロンファミリー分子の総称であり、ウイルス感染時に誘導されその排除を担う抗ウイルス因子として作用する。ウイルス核酸や細胞内に過剰に蓄積した核酸成分に反応して産生される。一方、ウイルス非依存的にIFN-Iの恒常的な産生を認めるインターフェロノパチーや全身性ループスエリテマトーデスなど一群の疾患が存在する。種々の神経変性疾患においても、脳内IFN-Iの過剰産生を示唆する報告が次々となされているが、それらが全てウイルス関連の反応とは考えにくいことから、細胞内に蓄積した何らかの内在性の核酸成分が関わる可能性が高いと考えられる。
注5)長鎖散在反復配列1(Long Interspersed Nuclear Element-1, LINE-1)
多くの真核生物のゲノムに分布する非LTR型レトロトランスポゾンの一種で、ヒトゲノムの場合、全体の2割強を占める特有の配列である。レトロウイルスと同様に、転写されたLINE-1mRNAと、自身がコードする2つのタンパク質(ORF1&ORF2)と協調して生成する逆転写産物が、ゲノム内に新たに挿入されるコピー&ペースト型の増殖様式を持つ。マウスでは約3000種、ヒトでは約100種の活性型LINE-1が存在すると予想されており、挿入箇所の遺伝子の破壊により、一部の先天性疾患の原因となることが知られている。とくに神経変性疾患患者の神経細胞の多くでは、LINE-1の異常な活性化が生じており、これによって引き起こされるゲノム不安定化が神経細胞死を促す可能性が指摘されているが、成熟した神経細胞におけるLINE-1活性化が神経細胞死を引き起こすメカニズムは不明である。
原著論文情報
・タイトル:Pathogenic microglia orchestrate neurotoxic properties of Eomes-expressing helper T cells
・著者名:Chenyang Zhang, Ben Raveney, Fumio Takahashi, Yeh Tzu-wen, Hirohiko Hohjoh, Takashi Yamamura, Shinji Oki,
・雑誌:Cells
・DOI:https://doi.org/10.3390/cells12060868
助成金
本研究成果は、以下の事業・研究領域・研究課題によって行われました。
・日本医療研究開発機構(AMED)難治性疾患実用化研究事業
・日本学術振興会・科学研究費補助金
・国立精神・神経医療研究センター・精神・神経疾患研究開発費
お問い合わせ先
【研究に関する問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
神経研究所 免疫研究部
TEL:042-341-2711 FAX: 042-346-1753
部長 山村 隆
E-mail:yamamura(a)ncnp.go.jp
室長 大木 伸司
E-mail:soki(a)ncnp.go.jp
【報道に関するお問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
総務課広報係
〒187-8551 東京都小平市小川東町4-1-1
TEL: 042-341-2711(代表) FAX: 042-344-6745
E-mail:ncnp-kouhou(a)ncnp.go.jp
※E-mailは上記アドレス(a)の部分を@に代えた上でご使用ください。